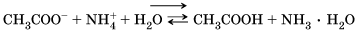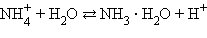Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гидролиз неорганических веществ
Водные растворы солей имеют разные значения рН и различные типы сред – кислотную (pH < 7), щелочную (pH > 7), нейтральную (pH = 7). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу. Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов H+ или ОН–, и раствор соли становится кислотным или щелочным соответственно. Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, соль KСlO образована сильным основанием KОН и слабой кислотой НСlO. В зависимости от силы основания и кислоты можно выделить 4 типа солей (рис 3).
Рисунок 3. Классификация солей
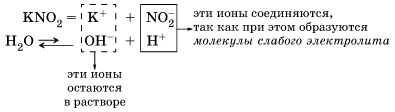
Рассмотрим поведение солей различных типов в растворе. I. Соли, образованные сильным основанием и слабой кислотой. Например, соль нитрит калия KNO2 образована сильным основанием KОН и слабой кислотой HNO2:
В водном растворе происходит полная диссоциация соли KNO2 = K+ + NO2– (сильный электролит) и очень незначительная диссоциация молекул воды
(очень слабый электролит):
Запишем полное ионное уравнение происходящего процесса (гидролиза):
Этот процесс обратим, и химическое равновесие смещено влево (в сторону образования исходных веществ), так как вода – значительно более слабый электролит, чем азотистая кислота HNO2. Сокращенное ионное уравнение гидролиза:
Уравнение показывает, что: 1. в растворе есть свободные гидроксид-ионы ОН– и концентрация их больше, чем в чистой воде, поэтому раствор соли KNO2 имеет щелочную среду (pH > 7); в реакции с водой участвуют анионы NO2–; в таком случае говорят, что идет гидролиз по аниону. 2. Другие примеры анионов, которые участвуют в реакции с водой:
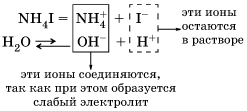
II. Соли, образованные сильной кислотой и слабым основанием. Например, рассмотрим гидролиз иодида аммония NH4I.
В водном растворе:
Полное ионное уравнение гидролиза:
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, так как вода Н2О значительно более слабый электролит, чем гидрат аммиака NH3 ∙ H2O. Сокращенное ионное уравнение гидролиза:
Уравнение показывает, что: 1.В растворе есть свободные ионы водорода Н+, и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду (pH < 7); в реакции с водой участвуют катионы аммония NH4+; в таком случае говорят, что идет гидролиз по катиону. 2.В реакции с водой могут участвовать и многозарядные катионы: двухзарядные M2+ (например, Ni2+, Cu2+, Zn2+,...), кроме катионов
щелочноземельных металлов, трехразрядные M3+ (например, Fe3+, Al3+, Cr3+,...). III. Соли, образованные слабым основанием и слабой кислотой. Вам, очевидно, уже ясно, что такие соли подвергаются гидролизу и по катиону, и по аниону. Катион слабого основания связывает ионы ОН– из молекул воды, образуя слабое основание; анион слабой кислоты связывает ионы Н+ из молекул воды, образуя слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислотной или слабощелочной. Это зависит от констант диссоциации двух слабых электролитов – кислоты и основания, которые образуются в результате гидролиза. Например, рассмотрим гидролиз соли 1. ацетата аммония NH4 (CH3COO) и
В водном растворе:
Запишем ионные уравнения гидролиза:
В этом случае гидролиз обратимый, но равновесие смещено в сторону образования продуктов гидролиза – двух слабых электролитов. В этом случае среда раствора нейтральная (pH = 7), так как K д(СН3СООН) = K д(NH3 ∙ H2O) = 1,8 ∙ 10–5. Гидролиз большинства солей является обратимым процессом. В состоянии химического равновесия гидролизована лишь часть соли. Однако некоторые соли полностью разлагаются водой, то есть их гидролиз является необратимым процессом. Подведем итог тому, что вы узнали о гидролизе и по катиону, и по аниону: 2. если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо; 3. реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующегося основания и кислоты;
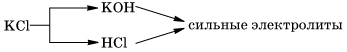
4. соли могут гидролизоваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции. IV. Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу. К этому выводу вы пришли, очевидно, сами. Рассмотрим «поведение» в растворе хлорида калия KСl.
В водном растворе:
Все ионы останутся в растворе, они не могут объединяться, так как при этом не образуются слабые электролиты – гидролиз не происходит. Среда раствора нейтральная (pH = 7), так как концентрации ионов Н+ и ОН– в растворе равны, как в чистой воде. Гидролиз можно подавить (значительно уменьшить количество подвергающейся гидролизу соли), действуя следующим образом: 1. увеличить концентрацию растворенного вещества; 2. охладить раствор (для ослабления гидролиза растворы солей следует хранить концентрированными и при низких температурах); 3. ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его среда в результате гидролиза кислотная, или подщелачивать, если – щелочная. Гидролиз солей имеет и практическое, и биологическое значение. Еще в древности в качестве моющего средства использовали золу. В золе содержится карбонат калия K2СО3, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе ионов ОН.– В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла – это натриевые или калиевые соли высших жирных карбоновых кислот: стеараты, пальмитаты, которые гидролизуются. Гидролиз стеарата натрия C17H35COONa выражается следующим ионным уравнением:
то есть раствор имеет слабощелочную среду. В состав же стиральных порошков и других моющих средств специально вводят соли неорганических кислот (фосфаты, карбонаты), которые усиливают моющее действие за счет повышения pH среды. Соли, создающие необходимую щелочную среду раствора, содержатся в фотографическом проявителе. Это карбонат натрия Na2CO3, карбонат калия K2СО3, бура Na2B4O7 и другие соли, гидролизующиеся по аниону. Если кислотность почвы недостаточная, у растений появляется болезнь – хлороз. Ее признаки – пожелтение или побеление листьев, отставание в росте и развитии. Если pHпочвы > 7,5, то в нее вносят аммония (NH4) 2 SO4, которое способствует повышению кислотности, благодаря гидролизу по катиону, проходящему в почве:
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав нашего организма. Например, в составе крови содержатся соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды. Это происходит за счет смещения равновесия процессов гидролиза:
Если в крови избыток ионов Н+, они связываются с гидроксидионами OH– и равновесие смещается вправо. При избытке гидроксид-ионов OH– равновесие смещается влево. Благодаря этому кислотность крови здорового человека колеблется незначительно. Другой пример: в составе слюны человека есть ионы НРО42–. Благодаря им в полости рта поддерживается определенная среда (pH = 7 – 7,5).
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 87; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.186.92 (0.016 с.) |