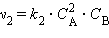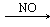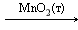Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II. По изменению степеней окисления химических элементов, образующих вещества
По этому признаку различают следующие реакции: Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции. К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
Реакции, идущие без изменения степеней окисления химических элементов. К ним, например, относятся все реакции ионного обмена, а также многие реакции соединения, например: Li2O + Н2O = 2LiOH, многие реакции разложения:
реакции этерификации:
III. По тепловому эффекту По тепловому эффекту реакции делят на экзотермические и эндотермические. 1.Экзотермические реакции протекают с выделением энергии. К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом: N2 + O2 = 2NO – Q Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например: 4P + 5O2 = 2P2O5 + Q Гидрирование этилена – пример экзотермической реакции:
Она идет при комнатной температуре. 2.Эндотермические реакции протекают с поглощением энергии. Очевидно, что к ним будут относиться почти все реакции разложения, например: 1. Обжиг известняка:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например: H2(г) + Cl2(г) = 2HCl(г) + 92,3 кДж N2(г) + O2(г) = 2NO(г) – 90,4 кДж
По агрегатному состоянию реагирующих веществ различают: 1. Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах): 2Al(т) + 3CuCl2(р-p) = 3Cu(т) + 2AlCl3(р-p) CaC2(т) + 2H2O(ж) = C2H2 ↑ + Ca(OH)2(р-p) Гомогенные реакции – реакции, в которых реагирующие вещества и
2. продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
H2(г) + F2(г) = 2HF(г)
V. По участию катализатора По участию катализатора различают: 1. Некаталитические реакции, идущие без участия катализатора:
2. Каталитические реакции, идущие с участием катализатора:
Этанол этен
Так как все биохимические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы – ферментов, все они относятся к каталитическим или, точнее, ферментативным. Следует отметить, что более 70 % химических производств используют катализаторы. VI. По направлению По направлению различают: 1. Необратимые реакции протекают в данных условиях только в одном направлении. К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения.
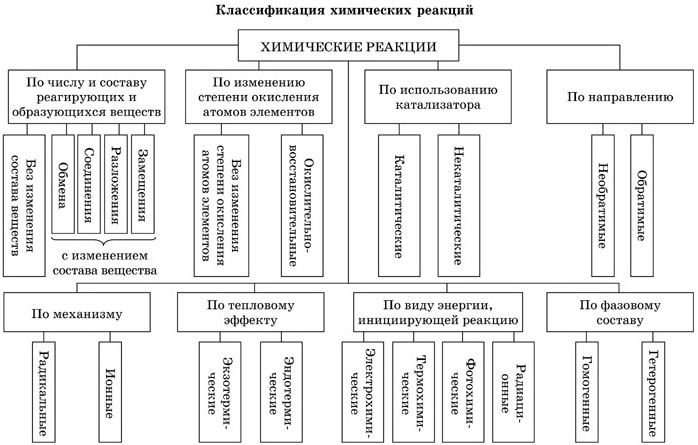
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях. Таких реакций подавляющее большинство. В органической химии признак обратимости отражают названия – антонимы процессов: · гидрирование – дегидрирование, · гидратация – дегидратация, Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость этих процессов лежит в основе важнейшего свойства живого организма – обмена веществ. Рассмотренная выше классификация химических реакций отражена на рис 1.
Рисунок 1. Классификация химических реакций
Классификация химических реакций, как и все другие классификации, условна. Ученые договорились разделить реакции на определенные типы по выделенным ими признакам. Но большинство химических превращений можно отнести к разным типам. Например, составим характеристику процесса синтеза аммиака:
Это реакция соединения, окислительно-восстановительная, экзотермическая, обратимая, каталитическая, гетерогенная (точнее, гетерогенно-каталитическая), протекающая с уменьшением давления в системе. Для успешного управления процессом необходимо учитывать все приведенные сведения. Конкретная химическая реакция всегда многокачественна, ее характеризуют разные признаки.
Скорость химических реакций Химические реакции протекают с разными скоростями.Очень быстро проходят реакции в водных растворах, практически мгновенно. Смешаем растворы хлорида бария и сульфата натрия – сульфат бария в виде осадка образуется немедленно. Быстро, но не мгновенно горит сера, магний растворяется в соляной кислоте, этилен обесцвечивает бромную воду. Медленно образуется ржавчина на железных предметах, налет на медных и бронзовых изделиях, гниет листва, разрушаются зубы. Если химические реакции происходят в однородной среде, например в растворе или в газовой фазе, то взаимодействие реагирующих веществ происходит во всем объеме. Такие реакции, как вы знаете, называют гомогенными. Скорость гомогенной реакции (v гомог) определяется как изменение количества вещества в единицу времени в единице объема:
где Δ n – изменение числа молей одного из веществ (чаще всего исходного, но может быть и продукта реакции); Поскольку отношение количества веществ к объему представляет собой молярную концентрацию C, то
Таким образом, скорость гомогенной реакции определяется как изменение концентрации одного из веществ в единицу времени:
если объем системы не меняется. Если реакция идет между веществами, находящимися в разных агрегатных состояниях (например, между твердым веществом и газом или жидкостью) или между веществами, неспособными образовывать гомогенную среду (например, между несмешивающимися жидкостями), то она проходит только на поверхности соприкосновения веществ. Такие реакции, как вы также знаете, называют гетерогенными. Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единице поверхности:
где S — площадь поверхности соприкосновения веществ (м2,см2). Изменение количества вещества, по которому определяют скорость реакции, – это внешний фактор, наблюдаемый исследователем. По сути, все процессы осуществляются на микроуровне. Очевидно, для того чтобы какие-то частицы прореагировали, они прежде всего должны столкнуться. Причем столкнуться эффективно: не разлететься как мячики в разные стороны, а так, чтобы в частицах разрушились или ослабли «старые связи» и смогли образоваться «новые», а для этого частицы должны обладать достаточной энергией. Скорость химической реакции зависит от многих факторов. Основными из них являются: природа и концентрация реагирующих веществ, давление (в реакциях с участием газов), температура, действие катализаторов и поверхность реагирующих веществ в случае гетерогенных реакций. Рассмотрим влияние каждого из этих факторов на скорость химической реакции.
Значение энергии активации является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции. Если энергия активации мала (< 40 кДж/моль), то это означает, что значительная часть столкновений между частицами реагирующих веществ приводит к их взаимодействию, и скорость такой реакции очень большая. Все реакции ионного обмена протекают практически мгновенно, ибо в этих реакциях участвуют разноименно заряженные ионы, и энергия активации в этих случаях ничтожно мала.
Если энергия активации велика (> 120 кДж/моль), то это означает, что лишь ничтожная часть столкновений между взаимодействующими частицами приводит к реакции. Скорость такой реакции поэтому очень мала. Например, протекание реакции синтеза аммиака при обычной температуре заметить практически невозможно. Если энергии активации химических реакций имеют промежуточные значения (40 ÷ 120 кДж/моль), то скорости таких реакций будут средними. К таким реакциям можно отнести взаимодействие натрия с водой или этиловым спиртом, обесцвечивание бромной воды этиленом, взаимодействие цинка с соляной кислотой и др.
Температура Вам известно, что при повышении температуры в большинстве случаев скорость химической реакции значительно увеличивается. В прошлом веке голландский химик Я. Х. Вант-Гофф сформулировал правило: Повышение температуры на каждые 10 °С приводит к увеличению скорости реакции в 2–4 раза (эту величину называют температурным коэффициентом реакции). При повышении температуры средняя скорость молекул, их энергия, число столкновений увеличиваются незначительно, зато резко повышается доля «активных» молекул, участвующих в эффективных соударениях, преодолевающих энергетический барьер реакции. Математически эта зависимость выражается соотношением
где v t1, v t2 – скорости реакций соответственно при конечной t 2 и начальной t 1 температурах, а γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры на каждые 10 °С. Однако для увеличения скорости реакции повышение температуры не всегда применимо, так как исходные вещества могут начать разлагаться, испаряться растворители или сами вещества и т. д.
Изменение давления при участии в реакции газообразных веществ также приводит к изменению концентрации этих веществ. Чтобы осуществилось химическое взаимодействие между какими-то частицами, они должны эффективно столкнуться. Чем больше концентрация реагирующих веществ, тем больше столкновений и соответственно скорость реакции. Например, в чистом кислороде ацетилен сгорает очень быстро. При этом развивается температура, достаточная для плавления металла (рис. 4). На основе большого экспериментального материала в 1867 г. норвежцами К. Гульдбергом и П. Вааге и независимо от них в 1865 г. русским ученым Н. И. Бекетовым был сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ:
Cкорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции. Этот закон называют также законом действующих масс. Для реакции А + В = D этот закон выразится так: v 1 = k 1 ∙ C A ∙ C B Для реакции 2А + В = D этот закон выразится так:
Здесь СA, C B – концентрации веществ А и В (моль/л), k 1 и k 2 – коэффициенты пропорциональности, называемые константами скорости реакции. Физический смысл константы скорости реакции нетрудно установить — она численно равна скорости реакции, в которой концентрации реагирующих веществ равны 1моль/л или их произведение равно единице. В таком случае ясно, что константа скорости реакции зависит только от температуры и не зависит от концентрации веществ. Закон действующих масс не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, так как они реагируют на поверхности и их концентрации обычно являются постоянными. Например, для реакции горения угля С + О2 = СО2 выражение скорости реакции должно быть записано так: v = k ∙ C O2, то есть скорость реакции пропорциональна только концентрации кислорода. Если же уравнение реакции описывает лишь суммарную химическую реакцию, проходящую в несколько стадий, то скорость такой реакции может сложным образом зависеть от концентрации исходных веществ. Эта зависимость определяется экспериментально или теоретически на основании предполагаемого механизма реакции. Действие катализаторов Можно увеличить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией активации (рис.5,). Их называют катализаторами (от лат. katalysis — разрушение). Катализаторы – это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но по окончании реакции остающиеся неизменными качественно и количественно. Изменение скорости химической реакции или ее направления с помощью катализатора называют катализом. Катализаторы широко используют в различных отраслях промышленности и на транспорте (рис. 6). Различают два вида катализа. Гомогенный катализ, при котором и катализатор, и реагирующие вещества находятся в одном агрегатном состоянии (фазе). Механизм действия такого катализатора состоит в образовании промежуточного вещества. При этом понижается энергия активации. Например, при старом способе производства серной кислоты нитрозным способом окисление оксида серы (IV) в оксид серы (VI) проводили с помощью катализатора NO – оксида азота (II). При этом катализатор вначале взаимодействовал с кислородом, образуя промежуточное более активное вещество – оксид азота (IV), который далее взаимодействовал с SO2, окисляя его в SO3:
NO + 0,5 О 2 → NO2
Гетерогенный катализ, при котором катализатор и реагирующие вещества находятся в разных фазах. Например, разложение пероксида водорода в присутствии твердого катализатора оксида марганца (IV):
Как и в случае гомогенного катализа, при гетерогенном катализе реакция протекает через активные промежуточные соединения — активированные комплексы, которые представляют поверхностные соединения катализатора с реагирующими веществами. Сначала происходит адсорбция, то есть поглощение молекул реагирующих веществ пористой поверхностью катализатора, с образованием активных частиц, участвующих в реакции. Молекулы продуктов не образуют прочных связей с катализатором и десорбируются. Сам катализатор не расходуется в результате реакции, но если на его поверхности адсорбируются другие вещества (их называют каталитическими ядами), то поверхность становится неработоспособной, требуется регенерация катализатора. Поэтому перед проведением каталитической реакции тщательно очищают исходные вещества. Например, при производстве серной кислоты контактным способом используют твердый катализатор – оксид ванадия (V) V2O5:
Очень эффективно работают биологические катализаторы — ферменты Как вы помните, по химической природе это белки. Благодаря им в живых организмах при невысокой температуре с большой скоростью протекает множество сложных химических реакций. Ферменты отличаются особой специфичностью, каждый из них ускоряет только «свою» реакцию, идущую в нужное время и в нужном месте с выходом, близким к 100 %. Создание аналогичных ферментам искусственных катализаторов – мечта химиков! Вы, конечно, слышали и о других интересных веществах – ингибиторах (от лат. inhibere – задерживать). Они с высокой скоростью реагируют с активными частицами с образованием малоактивных соединений. В результате скорость реакции резко замедляется и она прекращается. Ингибиторы часто специально добавляют в разные вещества, чтобы предотвратить нежелательные процессы. Ингибиторы содержатся и в живых организмах, они подавляют различные вредные реакции окисления в клетках тканей, которые могут инициироваться, например, радиоактивным излучением.
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 92; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.57.52 (0.05 с.) |

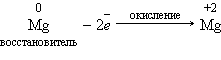


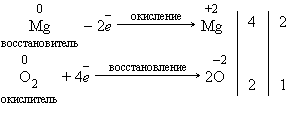


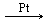

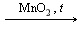


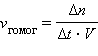
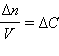
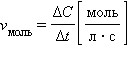
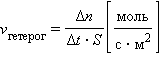
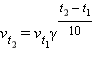 ,
,