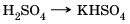Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
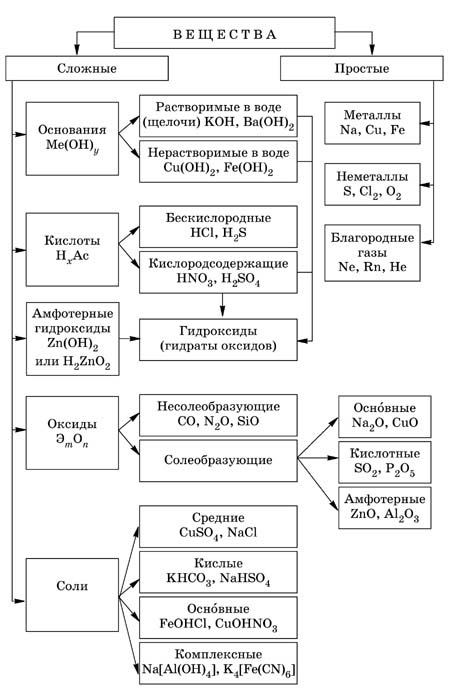
Классификация органических и неорганических веществ
Самая простая классификация заключается в том, что все известные вещества делят на неорганические и органические. К органическим веществам относят углеводороды и их производные. Все остальные вещества – неорганические.
Неорганические вещества по составу делят на простые и сложные Простые вещества состоят из атомов одного химического элемента и подразделяются на металлы, неметаллы, благородные газы. Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания, кислоты, амфотерные гидроксиды, соли. Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со степенью окисления (–2). Общая формула оксидов: Э m О n, где m – число атомов элемента Э, a n – число атомов кислорода. Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобразующие. Солеобразующие делятся на основные, амфотерные, кислотные, которым соответствуют основания, амфотерные гидроксиды, кислоты соответственно. Основания – это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп
Общая формула оснований: Основания делятся на растворимые (щелочи) и нерастворимые Примеры оснований: NaOH, Ba(OH)2, Mg(OH)2. Кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. Общая формула кислот: Н x Ас, где Ac – кислотный остаток (от английского "acid" – кислота), х – число атомов водорода, равное заряду иона кислотного остатка Примеры кислот: HCl, H2SO4, Н3РО4. Амфотерные гидроксиды – это сложные вещества, которые проявляют и свойства кислот, и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать и в форме кислот, и в форме оснований
Например:
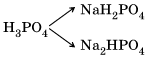
Соли – это сложные вещества, состоящие из катионов металла и анионов кислотных остатков.
Такое определение относится к средним солям. Средние соли – это продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками. Например: H2SO4 → K2SO4, Fe(OH)2 → Fe(NO3)2 Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла. Например:
Основные соли – это продукты неполного замещения гидроксогрупп многокислотных основаниях кислотными остатками. Например: Fe(OH)2 → FeOHCl, Cu(OH)2 → CuOHNO3 Помимо средних, кислых, основных солей вы встречались с солями более сложного строения – комплексными: Na [ Al(OH)4 ], K4 [ Fe(CN)6 ], [ Cu(H2O) 4 ] SO4 ∙ Н2О (о строении комплексных соединений вы узнаете несколько позже). К солям относят также продукты взаимодействия аминов с кислотами. Например, [ C6H5NH3 ] Cl, [ CH3NH3 ] NO3
Классификация неорганических веществ представлена на рис.1.
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 39; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.233.41 (0.008 с.) |
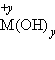 , где y – число гидроксогрупп, равное степени окисления металла
, где y – число гидроксогрупп, равное степени окисления металла  (как правило, +1 и +2).
(как правило, +1 и +2).