
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие со сложными веществами
1. С водой. Щелочные и щелочноземельные металлы при обычных условиях вытесняют водород из воды и образуют растворимые основания-щелочи, например:
2. Другие металлы, стоящие в ряду напряжений до водорода, тоже могут при определенных условиях вытеснять водород из воды. Но алюминий бурно взаимодействует с водой, только если удалить с его поверхности оксидную пленку:
3. Магний взаимодействует с водой только при кипячении, при этом также выделяется водород:
4.Железо взаимодействует с водой только в раскаленном виде:
5. С кислотами в растворе (HCl, H2SO4разб, СН3СООН и др., кроме HNO3) взаимодействуют металлы, стоящие в ряду напряжений до водорода. При этом образуются соль и водород. Например:
6 .С солями менее активных металлов в растворе. В результате такой реакции образуется соль более активного металла и выделяется менее активный металл в свободном виде. Например:
Нужно помнить, что реакция идет в тех случаях, когда образующаяся соль растворима. Вытеснение металлов из их соединений другими металлами впервые подробно изучал Н. Н. Бекетов – крупный русский физикохимик. Он расположил металлы по химической активности в «вытеснительный ряд», ставший прототипом ряда напряжений металлов. 7 .С органическими веществами. Взаимодействие с органическими кислотами аналогично реакциям с минеральными кислотами. Спирты же могут проявлять слабые кислотные свойства при взаимодействии со щелочными металлами:
Коррозия металлов При взаимодействии металлов с веществами окружающей среды на их поверхности образуются соединения, обладающие совершенно иными свойствами, чем сами металлы. В обычной жизни мы часто употребляем слова «ржавчина», «ржавление», видя коричнево-рыжий налет на изделиях из железа и его сплавов. Ржавление – это частый случай коррозии. Коррозия – это процесс самопроизвольного разрушения металлов и сплавов под влиянием внешней среды (от лат. corrosio – разъедание). Однако разрушению подвергаются практически все металлы, в результате чего многие их свойства ухудшаются (или совсем теряются): уменьшаются прочность, пластичность, блеск, снижается электропроводность, а также возрастает трение между движущимися деталями машин, изменяются размеры деталей и т. д.
Коррозия металлов бывает сплошной и местной. Первая не так опасна, как вторая, ее проявления могут быть учтены при проектировании конструкций и аппаратов. Значительно опаснее местная коррозия, хотя потери металла здесь могут быть и небольшими. Один из наиболее опасных ее видов – точечная. Она заключается в образовании сквозных поражений, то есть точечных полостей – питтингов, при этом снижается прочность отдельных участков, уменьшается надежность конструкций, аппаратов, сооружений. Коррозия металлов наносит большой экономический вред. Человечество несет огромные материальные потери в результате разрушения трубопроводов, деталей машин, судов, мостов, различного оборудования. Коррозия приводит к уменьшению надежности работы металлоконструкций. Учитывая возможное разрушение, приходится завышать прочность некоторых изделий (например, деталей самолетов, лопастей турбин), а значит, увеличивать расход металла, а это требует дополнительных экономических затрат. По химической природе коррозия – это окислительно-восстановительный процесс. В зависимости от среды, в которой он протекает, различают несколько видов коррозии. Наиболее часто встречающиеся виды коррозии: химическая и электрохимическая. I. Химическая коррозия происходит в не проводящей электрический ток среде. Такой вид коррозии проявляется в случае взаимодействия металлов с сухими газами или жидкостями – неэлектролитами (бензином, керосином и др.). Такому разрушению подвергаются детали и узлы двигателей, газовых турбин, ракетных установок. Химическая коррозия часто наблюдается в процессе обработки металлов при высоких температурах. Например:
Большинство металлов окисляется кислородом воздуха, образуя на поверхности оксидные пленки. Если эта пленка прочная, плотная, хорошо связана с металлом, то она защищает металл от дальнейшего разрушения. Такие защитные пленки появляются у Zn, Al, Cr, Ni, Sn, Pb, Nb, Ta и др. У железа она рыхлая, пористая, легко отделяется от поверхности и потому не способна защитить металл от дальнейшего разрушения.
Электрохимическая коррозия происходит в токопроводящей среде (в электролите) с возникновением внутри системы электрического тока. Как
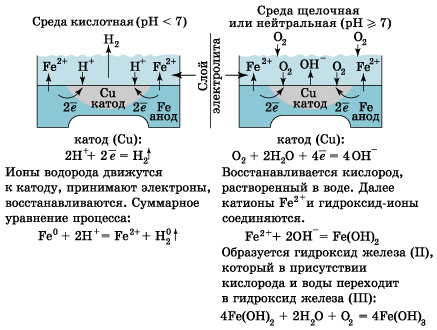
II. правило, металлы и сплавы неоднородны, содержат включения различных примесей. При контакте их с электролитами одни участки поверхности начинают выполнять роль анода (отдают электроны), а другие – роль катода (принимают электроны). Рассмотрим разрушение железного образца в присутствии примеси меди. На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит: Fe0 – 2e = Fe2+ (анод) Таким образом, железо (его основная часть) служит анодом. Поток электронов перемещается к меди – металлу с меньшей активностью, на ней накапливается избыточное количество электронов. Таким образом, медные участки могут «поделиться» электронами, поэтому на них возможны процессы восстановления. Примесь меди выполняет роль катода. В зависимости от среды электролита на катоде могут идти разные процессы (рис.).
Рисунок Процессы, протекающие на катоде
В одном случае будет наблюдаться выделение газа (Н2). В другом – образование ржавчины, состоящей в основном из Fe2O3 ∙ n H2O. Итак, электрохимическая коррозия –окислительно-восстановительная реакция, происходящая в средах, проводящих ток (в отличие от химической коррозии). Процесс происходит при соприкосновении двух металлов или на поверхности металла, содержащего включения, которые являются менее активными проводниками (это может быть и неметалл). На аноде (более активном металле) идет окисление атомов металла с образованием катионов (растворение). На катоде (менее активном проводнике) идет восстановление ионов водорода или молекул кислорода с образованием соответственно Н2 ↑ или гидроксид-ионов ОН–. Катионы водорода и растворенный кислород – важнейшие окислители, вызывающие электрохимическую коррозию. Скорость коррозии тем больше, чем сильнее отличаются металлы (металл и примеси) по своей активности (для металлов – чем дальше друг от друга они расположены в ряду напряжений). Значительно усиливается коррозия при увеличении температуры. Электролитом может служить морская вода, речная вода, конденсированная влага и конечно же хорошо известные всем электролиты – растворы солей кислот, щелочей. Способы защиты от коррозии Уже при проектировании металлических конструкций и их изготовлении предусматривают меры защиты от коррозии. 1. Шлифование поверхностей изделия, чтобы на них не задерживалась влага. 2. Применение легированных сплавов, содержащих специальные добавки: хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой (например, Сr2O3). Общеизвестны легированные стали – «нержавейки», из которых изготавливают предметы домашнего обихода (ножи, вилки, ложки), детали машин, инструменты. Нанесение защитных покрытий. Рассмотрим их виды. Неметаллические – неокисляющиеся масла, специальные лаки, краски, эмали.Правда, они недолговечны, но зато дешевы. Химические – искусственно создаваемые поверхностные пленки: оксидные, нитридные, силицидные, полимерные и др. Например, все стрелковое оружие и детали многих точных приборов подвергают воронению – это процесс получения тончайшей пленки оксидов железа на поверхности стального изделия. Получаемая искусственная оксидная пленка очень прочная (в основном из вещества состава (
Наносят их двумя способами: нагретое изделие помещают в порошок полимера, который плавится и приваривается к металлу, или поверхность металла обрабатывают раствором полимера в низкокипящем растворителе, который быстро испаряется, а полимерная пленка остается на изделии. Металлические – это покрытия другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные пленки. Нанесение хрома на поверхность – хромирование, никеля – никелирование, цинка – цинкование, олова – лужение и т. д. Покрытием может служить и пассивный в химическом отношении металл – золото, серебро, медь.
|
||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 33; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.67.203 (0.011 с.) |


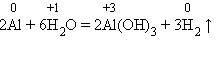
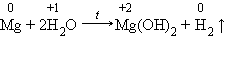
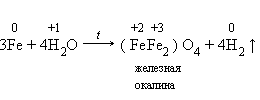
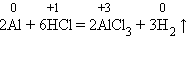
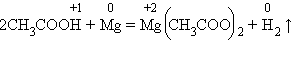
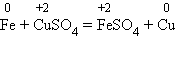
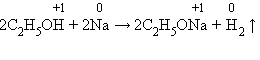
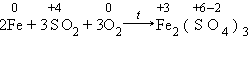
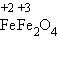 ) и придает изделию красивый черный цвет и синий отлив. Полимерные покрытия изготавливают из полиэтилена, полихлорвинила, полиамидных смол.
) и придает изделию красивый черный цвет и синий отлив. Полимерные покрытия изготавливают из полиэтилена, полихлорвинила, полиамидных смол.


