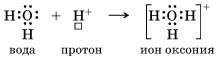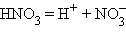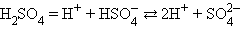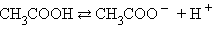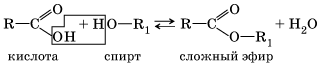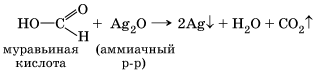Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислоты органические и неорганические
Кислотами называют сложные вещества, которые состоят из атомов водорода, способных замещаться на металл, и кислотного остатка. В свете теории электролитической диссоциации к кислотам относят электролиты, которые при диссоциации образуют катионы только одного типа – гидратированные ионы водорода. Теория электролитической диссоциации объясняет кислотноосновные свойства водных растворов электролитов присутствием в них избытка ионов Н+ (точнее, H3O+) или ОН–: HClO4 → H+ + ClO4– NaOH → Na+ + ОН – Наряду с этим известны реакции, в которых вещества взаимодействуют как кислота и основание при отсутствии в них ионов водорода и гидроксидионов. Вспомните, например, образование хлорида аммония при взаимодействии газообразных хлороводорода и аммиака, известное вам как «дым без огня»: НСl(г) + NH3(г) = NH4Cl(т) кислоты – это молекулы или ионы, которые являются в данной реакции донорами катионов водорода H+, то есть отдают их. Соответственно, основания – это молекулы или ионы, которые принимают катионы H+, то есть являются акцепторами Н+. В реакции получения NH4Cl хлороводород отдает H+ аммиаку, следовательно, HCl ведет себя как кислота, а NH3 – как основание. Так как атом водорода состоит только из протона и электрона, то ион Н+ представляет собой протон, поэтому кислоту иногда называют донором протонов, а основание – акцептором протонов. Очевидно, вам теперь стала понятной и этимология названия теории – протолитическая (синтез терминов «протон» и «электролит»). С точки зрения этой теории распад электролита на ионы (1) и гидролиз по аниону (2) рассматривают как кислотно-основное взаимодействие электролитов и воды:
В реакции (1) Н2О ведет себя как основание – присоединяет протон (Н+) и образует ион оксония по донорно-акцепторному механизму:
Ион оксония Н3O+ содержится в каждом кислотном растворе. Но он и сам может играть роль кислоты – отдавать Н+ и превращаться в молекулу воды. В уравнениях реакций мы будем пользоваться более простым обозначением иона оксония – H+. Теперь, когда вы познакомились с более широким взглядом на природу кислотноосновных свойств химических соединений, сделаем обобщение сведений о классе кислот, рассмотрев классификацию и свойства неорганических и органических кислот (табл.).
Таблица Классификация кислот
Свойства кислот Кислый вкус, действие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами – эти свойства являются общими для неорганических и органических кислот. 1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например: HCl = H+ + Cl–
Растворы кислот изменяют цвет индикаторов: лакмуса – в красный, метилового оранжевого – в розовый, цвет фенолфталеина не изменяют. 2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли. а) 2H+ + Zn = Zn2+ + H2 ↑ Например, 2HCl + Zn = ZnCl2 + H2 ↑
Уксусная ацетат-ион 3.Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль: а) 2H+ + ZnO = Zn2+ + H2O Например, 2HCl + ZnO = ZnCl2 + H2O б) 2 CH 3 COOH + CaO = 2 CH 3 COO – + Ca 2+ + H 2 O
4.И те и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовать как средние, так и кислые соли (это реакции нейтрализации): а) H+ + OH– = H2O Например, HCl + NaOH = H2O + NaCl б) 2CH3COOH + Mg(OH)2 = 2CH3COO– + Mg2+ + 2H2O 5 Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ: 2H+ + CaCO3 = Ca2+ + H2O + CO2↑
Аналогично с уксусной кислотой:
Взаимодействие H3PO4 с известняком прекратится из–за образования на поверхности последнего нерастворимого осадка Ca3 (РО4) 2. 6.Сложные эфиры образуют не только органические кислоты согласно общему уравнению:
7.но и неорганические кислоты, например азотная и серная:
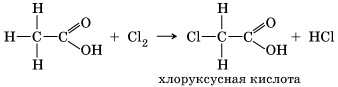
Уксусная кислота СН3СООН, как и другие карбоновые кислоты, содержит в молекуле углеводородный радикал. В нем возможны реакции замещения водорода галогенами:
Под влиянием атомов галогена в молекуле кислоты ее степень диссоциации сильно повышается. Муравьиная кислота НСООН, в отличие от уксусной, не имеет в молекуле углеводородного радикала. Вместо него она содержит атом водорода, а потому является веществом с двойственной функцией — альдегидокислотой и, в отличие от других карбоновых кислот, дает реакцию «серебряного зеркала». Образующаяся угольная кислота Н2СО3 распадается на воду и углекислый газ.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 130; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.142.62 (0.015 с.) |