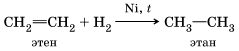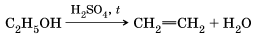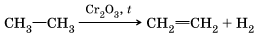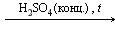Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена. Реакции соединения – это такие реакции, при которых из двух и более веществ образуется одно сложное вещество. В неорганической химии все многообразие реакций соединения можно рассмотреть, например, на примере реакций получения серной кислоты из серы: Получение оксида серы (IV): S + O2 = SO2 – из двух простых веществ образуется одно сложное. Получение оксида серы (VI):
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты: 4NO2 + О2 + 2Н2O = 4HNO3 В органической химии реакции соединения принято называть «реакциями присоединения». Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена: Реакция гидрирования – присоединения водорода:
Реакции разложения – это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ. В неорганической химии все многообразие таких реакций можно рассмотреть на блоке реакций получения кислорода лабораторными способами: Разложение оксида ртути (II):
В органической химии реакции разложения можно рассмотреть на блоке реакций получения этилена в лаборатории и в промышленности: Реакция дегидратации (отщепления воды) этанола:
Реакция дегидрирования (отщепление водорода) этана:
Реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе. B неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов: Взаимодействие щелочных или щелочноземельных металлов с водой: Взаимодействие металлов с кислотами в растворе: Zn + 2HCl = ZnCl2 + H2↑ Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, – способность его атомов водорода замещаться на атомы галогена:
хлорметан
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например нитрование бензола:
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма. Реакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями. Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, то есть только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, Н2О). B неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей: Реакция нейтрализации, идущая с образованием соли и воды: NaOH + HNO3 = NaNO3 + Н2O или в ионном виде: OH– + H+ = H2O Реакция между щелочью и солью, идущая с образованием газа: 2NH4Cl + Са(ОН)2 = CaCl2 + 2NH3↑ + 2Н2O B органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты: Реакция, идущая с образованием слабого электролита – H2O:
Реакция, идущая с образованием газа: 2CH3COOH + CaCO3 → 2CH3COO– + Ca2+ + CO2↑ + H2O Реакция, идущая с образованием осадка: 2CH3COOH + K2SiO3 → 2K(CH3COO) + H2SiO3↓
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 95; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.3.255 (0.005 с.) |