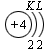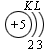Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронные конфигурации атомов химических элементов
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского "веретено"), Этот принцип носит название принципа Паули. Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, то есть электроны с противоположными спинами
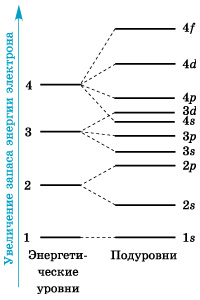
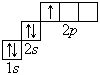
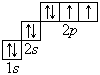
На рисунке 1 показана схема подразделения энергетических уровней на подуровни. s –Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода (n = 1) располагается на этой орбитали и неспарен. Поэтому его электронная формула или электронная конфигурация будет записываться так: 1 s 1. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой (1...), латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа вверху от буквы (как показатель степени), показывает число электронов на подуровне. Для атома гелия He, имеющего два спаренных электрона на одной s -орбитали, эта формула: 1 s 2. Электронная оболочка атома гелия завершена и очень устойчива. Гелий – это благородный газ. На втором энергетическом уровне (n = 2) имеется четыре орбитали: одна s и три p. Электроны s -орбитали второго уровня (2 s -opбитали) обладают более высокой энергией, так как находятся на большем расстоянии от ядра, чем электроны 1 s -орбитали (n = 2) p -Орбиталь имеет форму гантели или объемной восьмерки. Все три p -орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с n = 2, имеет три p -орбитали. С увеличением значения n электроны занимают p -орбитали, расположенные на больших расстояниях от ядра и направленные по осям х, у, z.
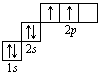
У элементов второго периода (n = 2) заполняется сначала одна s -орбиталь, а затем три p -орбитали. Электронная формула Li: 1 s 22 s 1. Электрон 2 s 1 слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион Li+.
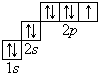
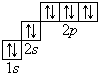
В атоме бериллия Be0 четвертый электрон также размещается на 2 s -орбитали: 1 s 22 s 2. Два внешних электрона атома бериллия легко отрываются – Ве0 при этом окисляется в катион Ве2+. У атома бора пятый электрон занимает 2 p -орбиталь: 1 s 22 s 22 p 1. Далее у атомов C, N, О, F идет заполнение 2 p -орбиталей, которое заканчивается у благородного газа неона: 1 s 22 s 22 p 6. У элементов третьего периода заполняются соответственно 3 s - и 3р-орбитали. Пять d -орбиталей третьего уровня при этом остаются свободными: · 11 Na 1 s 22 s 22 p 63 s 1; · 17 Cl 1 s 22 s 22 p 63 p 5; · 18 Ar 1 s 22 s 22 p 63 s 23 p 6. Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, то есть записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например: 11 Na 2, 8, 1; 17 Cl 2, 8, 7; 18 Ar 2, 8, 8. У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно 4 s - и 5 s -орбитали: 19 K 2, 8, 8, 1; 38 Sr 2, 8, 18, 8, 2. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие 3 d - и 4 d -орбитали соответственно (у элементов побочных подгрупп): 23 V 2, 8, 11, 2; 26 Fe 2, 8, 14, 2; 40 Zr 2, 8, 18, 10, 2; 43 Tr 2, 8, 18, 13, 2. Как правило, тогда, когда будет заполнен предыдущий d -подуровень, начнет заполняться внешний (соответственно 4р- и 5р-) p -подуровень: 33 As 2, 8, 18, 5; 52 Те 2, 8, 18, 18, 6. У элементов больших периодов – шестого и незавершенного седьмого – электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступят на внешний s -подуровень: 56 Ва 2, 8, 18, 18, 8, 2; 87 Fr 2, 8, 18, 32, 18, 8, 1; следующий один электрон (у La и Ac) на предыдущий d -подуровень: 57 La 2, 8, 18, 18, 9, 2 и 89 Ас 2,8,18, 32, 18, 9, 2. Затем последующие 14 электронов поступят на третий снаружи энергетический уровень на 4 f - и 5 f -орбитали соответственно у лантаноидов и актиноидов: · 64 Gd 2, 8, 18, 25, 9, 2 и
· 92 U 2, 8, 18, 32, 21, 9, 2. Затем снова начнет застраиваться второй снаружи энергетический уровень (d -подуровень): у элементов побочных подгрупп: 73 Та 2, 8, 18, 32, 11, 2; 104 Rf 2, 8, 18, 32, 32, 10, 2, – и, наконец, только после полного заполнения десятью электронами d -подуровня будет снова заполняться внешний p -подуровень:
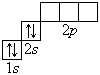
· 86 Rn 2, 8, 18, 32, 18, 8. Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек – записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки (орбитали), располагаются в них сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины при этом по принципу Паули будут уже противоположно направленными. В заключение еще раз рассмотрим отображение электронных конфигураций атомов элементов первого и второго периодов системы Д. И. Менделеева. Элементы первого периода
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и подуровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен – в нем 2 электрона. Водород и гелий – s -элементы, у этих атомов заполняется электронами s -opбиталь. Элементы второго периода У всех элементов второго периода первый электронный слой заполнен и электроны заполняют s - и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s -, а затем p -) и правилами Паули и Хунда (табл. 1). В атоме неона второй электронный слой завершен – в нем 8 электронов.
Li, Be – s -элементы. B, C, N, O, F, Ne – p -элементы, у этих атомов заполняются электронами p -орбитали.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 32; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.66.149 (0.015 с.) |