
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Учебно - методическое пособиеСтр 1 из 24Следующая ⇒
О.М.Воронова УЧЕБНО - МЕТОДИЧЕСКОЕ ПОСОБИЕ «ЛЕКЦИИ УЧЕБНОГО ПРЕДМЕТА «ХИМИЯ»»
Воронеж 2021 г. Учебно - методическое пособие «Лекции учебного предмета «Химия» разработаны на основе требований Федерального государственного образовательного стандарта среднего общего образования (утв. Приказом Министерства образования и науки РФ от 17.05.2012 г. № 413) по профессии: 43.01.09 Повар, кондитер, предназначены для использования учащимися с целью самостоятельного изучения предмета, коррекции знаний, при повторении и подготовке к экзаменам.
ОГЛАВЛЕНИЕ Атом - сложная частица. Состояние электронов в атоме…………………………………………….5 Электронная конфигурация атомов ………………………………………………………………… 7 ПЗ и ПС химических элементов Д. Менделеева…………………………………………………… 11 Значение периодического закона для развития науки……………………………………………….16 Химическая связь – ионная и ковалентная…………………………………………………………... 17 Химическая связь – металлическая и водородная ………………………………………………… 22 Дисперсные системы …………………………………………………………………………………. 24 Теория строения химических соединений А. М. Бутлерова…………………………………………28 Полимеры……………………………………………………………………………………………… 32 Классификация химических реакций ……………………………………………………………….. 37 Скорость химических реакций ……………………………………………………………………… 46 Обратимость химических реакций. Химическое равновесие……………………………………… 51 Электролитическая диссоциация. Гидролиз…………………………………………………………..57 Окислительно – восстановительные реакции…………………………………………………………65 Классификация органических и неорганических веществ………………………………………….. 66 Металлы………………………………………………………………………………………………… 74 Электрохимических ряд напряжений металлов. Коррозия металлов……………………………... 78
Общие способы получения металлов……………………………………………………………… 85 Неметаллы…………………………………………………………………………………………… 89 Высшие оксиды неметаллов. Водородные соединения…………………………………………….. 96 Кислоты органические и неорганические…………………………………………………………….100 Основания органические и неорганические…………………………………………………………. 105 Генетическая связь между классами соединений………………………………………………… 108 Химия и экология…………………………………………………………………………………… 113 Химия и повседневная жизнь человека……………………………………………………………... 119 Литература……………………………………………………………………………………………. 130
Атом – сложная частица. Состояние электронов в атоме. Атом – сложная частица. Атом – электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов. Электроны, протоны и нейтроны называют элементарными частицами. Каковы же свойства этих частиц? Корпускулярно-волновые свойства микромира. Элементарные частицы, а также построенные из них атомные ядра, атомы и молекулы имеют ничтожно малые массы и размеры и поэтому обладают своими особыми свойствами не похожими на те, которые имеют объекты окружающего нас макромира. Они образуют свой, специфический мир – микромир, который живет по особым законам, диктуемым квантовой механикой – наукой о строении и свойствах элементарных частиц, ядер, атомов и молекул. Квантовая механика характеризует частицы микромира как объекты с двойственной природой – корпускулярно-волновым дуализмом: они являются одновременно и частицами (корпускулами), и волнами. Электрон – частица, определяющая наиболее характерные химические свойства атомов и молекул. Двойственная природа электрона может быть подтверждена на опыте. Если электроны, испускаемые источником, например катодом, пропускать через маленькие отверстия в пластинке, поставленной на их пути, то они, попадая на фотопластинку, вызывают ее почернение. После проявления фотопластинки на ней можно увидеть совокупность чередующихся светлых и темных колец, то есть дифракционную картину (рис.1).
Рисунок 1. Электронограммы газов (слева) и кристаллов (справа). Дифракционная картина включает в себя как собственно дифракцию – огибание волной препятствия, так и интерференцию, то есть наложение волн друг на друга. Эти явления доказывают наличие у электрона волновых свойств, так как только волны способны огибать препятствия и налагаться друг на друга в местах их встречи. Однако, попадая на фотослой, электрон дает почернение лишь в одном месте, что свидетельствует о наличии у него корпускулярных свойств. Будь он только волной, он более или менее равномерно засвечивал бы всю пластинку. Элементы первого периода
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и подуровням.
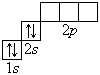
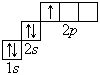
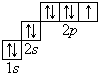
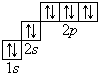
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
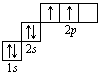
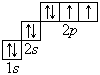
В атоме гелия первый электронный слой завершен – в нем 2 электрона. Водород и гелий – s -элементы, у этих атомов заполняется электронами s -opбиталь. Элементы второго периода У всех элементов второго периода первый электронный слой заполнен и электроны заполняют s - и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s -, а затем p -) и правилами Паули и Хунда (табл. 1). В атоме неона второй электронный слой завершен – в нем 8 электронов.
Li, Be – s -элементы. B, C, N, O, F, Ne – p -элементы, у этих атомов заполняются электронами p -орбитали. Открытие Д. И. Менделеевым Периодического закона В основу своей работы по классификации химических элементов Д. И. Менделеев положил два их основных и постоянных признака: величину атомной массы и свойства. Сопоставляя эти сведения, ученый составил естественные группы сходных по свойствам элементов, сравнение которых между собой показало, что даже элементы несходных групп имеют объединяющие их признаки. Ученый выделил периоды, в которых свойства химических элементов и образованных ими веществ закономерно изменяются. Рассмотрим эти изменения, используя современные термины. 1. Металлические свойства простых веществ, наиболее ярко выраженные у щелочных металлов, ослабевают и сменяются неметаллическими, которые наиболее ярко выражены у галогенов. 2. Значение степени окисления атомов элементов в высших оксидах возрастает от +1 до +7 (+8 только для Os и Ru). 3. Значение степени окисления атомов элементов в гидридах (соединениях металлов с водородом) и в летучих водородных соединениях возрастает сначала от +1 до +3 и затем от –4 до –1. Например:
4. Основные оксиды элементов начала периода сменяет амфотерный оксид и далее – кислотные, свойства которых усиливаются:
5.Гидроксиды-основания через амфотерный гидроксид сменяются все более сильными кислотами. Например:
На основании этих наблюдений Д. И. Менделеев сформулировал Периодический закон, который в соответствии с принятой в настоящее время терминологией звучит так: Ионная химическая связь Ионная химическая связь – это связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Атомы, присоединившие «чужие» электроны, превращаются в отрицательные ионы, или анионы. Атомы, отдавшие свои электроны, превращаются в положительные ионы, или катионы. Понятно, что между анионами и катионами возникают силы электростатического притяжения, которые и будут удерживать их друг около друга, осуществляя тем самым ионную химическую связь. Так как катионы образуют в основном атомы металлов, а анионы – атомы неметаллов, логично сделать вывод, что этот тип связи характерен для соединений типичных металлов (элементы главных подгрупп I и II групп, кроме магния Mg и бериллия Be) с типичными неметаллами (элементы главной подгруппы VII группы). Классическим примером является образование галогенидов щелочных металлов (фторидов, хлоридов и др.). Например, рассмотрим схему образования ионной связи в хлориде натрия:
Два разноименно заряженных иона, связанные силами притяжения, не теряют способности взаимодействовать с противоположно заряженными ионами, вследствие чего образуются соединения с ионной кристаллической решеткой. Ионные соединения представляют собой твердые, прочные, тугоплавкие вещества с высокой температурой плавления. Растворы и расплавы большинства ионных соединений – электролиты. Такой тип связи характерен для гидроксидов типичных металлов и многих солей кислородсодержащих кислот. Однако при образовании ионной связи не происходит идеального (полного) перехода электронов. Ионная связь является крайним случаем ковалентной полярной связи
Рисунок 1. Кристаллическая решетка хлорида натрия, состоящая из противоположно заряженных ионов натрия и хлорид-ионов
В ионном соединении ионы представлены как бы в виде электрических зарядов со сферической симметрией электрического поля, одинаково убывающего с увеличением расстояния от центра заряда (иона) в любом направлении (рис. 1). Поэтому взаимодействие ионов не зависит от направления, то есть ионная связь, в отличие от ковалентной, будет ненаправленной. Ионная связь существует также в солях аммония, где нет атомов металлов (их роль играет катион аммония
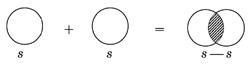
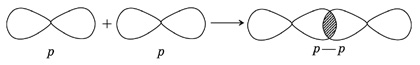
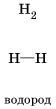
Ковалентная химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар. Механизм образования такой связи может быть обменный или донорно-акцепторный. Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов. Например: 1. Н2 – водород:
2. Связь возникает благодаря образованию общей электронной пары s -электронами атомов водорода (перекрыванию s -орбиталей):
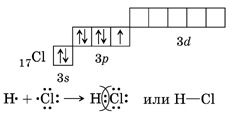
3. HCl – хлороводород:
4. Связь возникает за счет образования общей электронной пары из s - и p -электронов (перекрывания s – p -орбиталей):
5. Cl2 – в молекуле хлора ковалентная связь образуется за счет непарных p -электронов (перекрывания p – p -орбиталей):
6. N2 – в молекуле азота между атомами образуются три общие электронные пары:
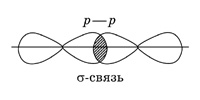
По способу перекрывания электронных орбиталей различают σ- и π-ковалентные связи (сигма- и пи-). В молекуле азота одна общая электронная пара образуется за счет σ-связи (электронная плотность находится в одной области, расположенной на линии, соединяющей ядра атомов; связь прочная).
Две другие общие электронные пары образуются за счет π-связей, то есть бокового перекрывания p -орбиталей в двух областях; π-связь менее прочна, чем σ-связь.
В молекуле азота между атомами существует одна σ-связь и две π-связи, которые находятся во взаимно перпендикулярных плоскостях (так как взаимодействуют 3 неспаренных p -электрона каждого атома). Следовательно, σ-связи могут образовываться за счет перекрывания электронных орбиталей:
а также за счет перекрывания «чистых» и гибридных орбиталей.
По числу общих электронных пар, связывающих атомы, то есть по кратности, различают ковалентные связи:
1. одинарные:
2. двойные:
3. тройные:
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть неполярной и полярной. При неполярной ковалентной связи общие электронные пары не смещены ни к одному из атомов, так как эти атомы имеют одинаковую электроотрицательность (ЭО) – свойство оттягивать к себе валентные электроны от других атомов.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной. Например:
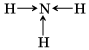
то есть посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов. Значения относительной электроотрицательности фосфора и водорода практически одинаковы: ЭО (Н) = 2,1; ЭО (Р) = 2,1, поэтому в молекуле фосфина PH3 связи между атомом фосфора и атомами водорода ковалентные неполярные. Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной. Например: аммиак
Азот – более электроотрицательный элемент, чем водород, поэтому общие электронные пары смещаются к его атому.
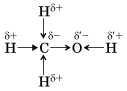
В метаноле CH3OH:
ЭО(O) > ЭО(C) > ЭО(H) 6. Химическая связь - металлическая связь и водородная Металлическая связь Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке, называют металлической. Такая связь характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно для атомов металлов. Схема образования металлической связи (М – металл):
Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск. Вещества с металлической связью имеют металлическую кристаллическую решетку. В ее узлах находятся ионы или атомы металла, между которыми свободно (в пределах кристалла) перемещаются электроны («электронный газ»).
Водородная связь Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары (F, О, N и реже Сl и S) другой молекулы (или ее части), называют водородной. Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер. Примеры межмолекулярной водородной связи:
При наличии такой связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород). В биополимерах – белках (вторичная структура) имеется внутримолекулярная водородная связь между карбонильным кислородом и водородом аминогруппы:
Вещества с водородной связью имеют молекулярные кристаллические решетки. Взвеси Взвеси – это дисперсные системы, в которых размер частиц фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсионная среда легко разделяются отстаиванием. Такие системы разделяют на: эмульсии (и среда, и фаза – нерастворимые друг в друге жидкости). Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т. д.; суспензии (среда – жидкость, а фаза – нерастворимое в ней твердое вещество). Это строительные растворы (например, «известковое молоко» для побелки), взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде – планктон, которым питаются гиганты-киты, и т. д.;
аэрозоли – взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различают пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний – взвесь мелких капелек жидкости в газе. Например, природные аэрозоли: туман, грозовые тучи – взвесь в воздухе капелек воды, дым – мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига – клинкера. Аналогичные вредные аэрозоли – пыли – имеются и в городах с металлургическими производствами. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающие изо рта больного гриппом, также вредные аэрозоли. Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопления облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, распыление топлив, выработка сухих молочных продуктов, лечение дыхательных путей (ингаляция) – примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли – туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие. Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы. Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах. Коллоидные системы Коллоидные системы – это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсионная среда в таких системах отстаиванием разделяются с трудом. Их подразделяют на золи (коллоидные растворы) и гели (студни). 1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма, содержимое органоидов и вакуолей) и живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки, гуморальные жидкости и т. д.).
2. Такие системы образуют клеи, крахмал, белки, некоторые полимеры. Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Но при определенных условиях может происходить процесс коагуляции. Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок – наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотнощелочной среды раствора. 3. Вторая подгруппа коллоидных систем – это гели, или студни, представляющие собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое количество полимерных гелей, столь хорошо известные вам кондитерские, косметические и медицинские гели (желатин, холодец, желе, мармелад, торт «Птичье молоко») и конечно же бесконечное множество природных гелей: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т. д. Историю развития жизни на Земле можно одновременно считать историей эволюции коллоидного состояния вещества. Со временем структура гелей нарушается – из них выделяется вода. Это явление называют синерезисом. Растворы Раствором называют гомогенную систему, состоящую из двух и более веществ. Растворы всегда однофазны, то есть представляют собой однородный газ, жидкость или твердое вещество. Это связано с тем, что одно из веществ распределено в массе другого в виде молекул, атомов или ионов (размер частиц менее 1 нм). Растворы называют истинными, если требуется подчеркнуть их отличие от коллоидных растворов. Растворителем считают то вещество, агрегатное состояние которого не изменяется при образовании раствора. Например, вода в водных растворах поваренной соли, сахара, углекислого газа. Если же раствор образовался при смешении газа с газом, жидкости с жидкостью и твердого вещества с твердым, растворителем считают тот компонент, которого больше в растворе. Так, воздух – это раствор кислорода, благородных газов, углекислого газа в азоте (растворитель). Столовый уксус, в котором содержится от 5 до 9 % уксусной кислоты, представляет собой раствор этой кислоты в воде (растворитель – вода). Но в уксусной эссенции роль растворителя играет уксусная кислота, так как ее массовая доля составляет 70–80 %, следовательно, это раствор воды в уксусной кислоте. При кристаллизации жидкого сплава серебра и золота можно получить твердые растворы разного состава. Растворы подразделяют на: · молекулярные – это водные растворы неэлектролитов – органических веществ (спирта, глюкозы, сахарозы и т. д.); · молекулярно-ионные – это растворы слабых электролитов (азотистой, сероводородной кислот и др.); · ионные – это растворы сильных электролитов (щелочей, солей, кислот – NaOH, K2SO4, HNО3, HClO4). Раньше существовали две точки зрения на природу растворения и растворов: физическая и химическая. Согласно первой растворы рассматривали как механические смеси, согласно второй – как нестойкие химические соединения частиц растворенного вещества с водой или другим растворителем. Последняя теория была высказана в 1887 г. Д. И. Менделеевым, который посвятил исследованию растворов более 40 лет. Современная химия рассматривает растворение как физико–химический процесс, а растворы как физико–химические системы.
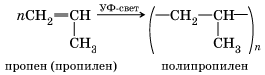
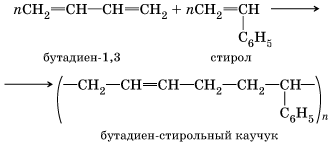
Полимеры Полимерами называют вещества, молекулы которых состоят из множества повторяющихся структурных звеньев, соединенных между собой химическими связями. Вы уже знаете два основных способа получения полимеров – реакции полимеризации и реакции поликонденсации. Реакции полимеризации Реакция полимеризации – это химический процесс соединения множества исходных молекул низкомолекулярного вещества (мономера) в крупные молекулы (макромолекулы) полимера. В реакцию полимеризации, как вы, очевидно, помните, могут вступать соединения, содержащие кратные связи, то есть непредельные соединения. Это могут быть молекулы одного мономера или разных мономеров. В первом случае происходит реакция гомополимеризации – соединение молекул одного мономера, во втором – реакция сополимеризации – соединение молекул двух и более исходных веществ. К реакциям гомополимеризации относятся реакции получения полиэтилена, полипропилена, поливинилхлорида и т. д., например:
Выражение в скобках называют структурным звеном, a число n в формуле полимера – степенью полимеризации. К реакциям сополимеризации относится, например, реакция получения бутадиен-стирольного каучука.
Реакция поликонденсации – это химический процесс соединения исходных молекул мономера в макромолекулы полимера, идущий с образованием побочного низкомолекулярного продукта (чаще всего воды). В реакции поликонденсации вступают молекулы мономеров с функциональными группами. Например, из молекул моносахаридов (глюкозы) в клетках растений образуются полисахариды:
Пластмассы Пластмассами называют материалы, изготовляемые на основе полимеров, способные приобретать при нагревании заданную форму и сохранять ее после охлаждения. Как правило, пластмасса – это смесь нескольких веществ; полимер – это лишь одно из них, но самое важное. Именно он связывает все компоненты пластмассы в единое, более или менее однородное целое. Поэтому полимер называют связующим. Первые пластмассы получали на основе природных полимеров – производных целлюлозы, каучука и т. д. Потом в качестве связующих стали применять и синтетические полимеры – фенолформальдегидные смолы, полиэфиры и т. д. Понятно, что превращать в готовые изделия удобнее те пластмассы, которые обратимо твердеют и размягчаются. Это так называемые термопласты, или термопластичные полимеры. Их можно рационально обрабатывать и перерабатывать методом литья под давлением, вакуумной формовки, профильным прессованием. К таким пластмассам относятся полиэтилен, полистирол, поливинилхлорид, полиамиды. Кроме связующего полимера в пластмассы часто вводят добавки разного назначения, наполнители, красители, вещества, повышающие механические свойства, термостойкость и устойчивость к старению. Наполнители в виде порошка или волокна, которые вводят в пластмассы, значительно удешевляют их. Вместе с тем они могут придать пластмассам и многие специфические свойства. Так, пластмассы с наполнителем в виде алмазной и карборундовой пыли – это абразивы, то есть отличный шлифовальный материал. Основные потребители пластмасс — это прежде всего строительная индустрия, машиностроение, электротехника, транспорт, производство упаковочных материалов, товаров народного потребления (рис. 2). Широкому применению пластмасс способствуют низкая стоимость, легкость переработки и свойства, которые часто не уступают металлам и сплавам или даже превосходят их. Так, изделия из пластмасс очень легкие, устойчивы коррозии и агрессивным средам, прочны, обладают отличными оптическими и изоляционными свойствами.
Волокна Волокна – это полимеры линейного строения, которые пригодны для изготовления нитей, жгутов, текстильных материалов. Природные волокна по происхождению делят на: растительные (хлопок, лен, пенька и т. д.); животные (шерсть, шелк); минеральные (асбест). Химические волокна получают из растворов или расплавов волокнообразующих полимеров. Их подразделяют на: искусственные, которые получают из природных полимеров или продуктов их переработки, главным образом из целлюлозы и ее эфиров (вискозные, ацетатные и др.); синтетические, которые получают из синтетических полимеров (капрон, лавсан, нейлон и др.). Биополимеры Биополимеры — это хорошо известные вам белки, полисахариды, нуклеиновые кислоты. Белки – это биополимеры, состоящие из остатков α-аминокислот. В белках выделяют четыре уровня структур: Первичную структуру белков можно рассматривать как линейную структуру. Она определяется порядком чередования остатков молекул аминокислот в полипептидной цепи и обусловливает белковую индивидуальность всех живых организмов на Земле. Как из букв алфавита можно построить бесконечное множество слов, так и из немногим более чем 20 α-аминокислот природа создает все многообразие белков. У каждого организма свой неповторимый, как рисунок отпечатков пальцев, набор белковых молекул. На неприятии «чужих» белковых наборов (например, микробных) основана такая защитная реакция организма, как иммунитет и отторжение. Вторичная структура белков (чаще всего спиралевидная) определяется особенностями скручивания (типом укладки) полипептидных цепей белковых молекул в спираль за счет возникновения водородных связей между группами Третичная структура белков (клубочковидная или глобулярная) определяется пространственным расположением белковых спиралей за счет возникновения водородных, амидных и дисульфидных связей. Третичная структура в виде определенной пространственной конфигурации с выступами и впадинами, с обращенными наружу функциональными группами обусловливает специфическую биологическую активность белковой молекулы (рис.4).
Вторичная (спиралевидная) структура молекулы белка
Модель молекулы белка миоглобина (третичная структура)
Некоторые белки (например, гемоглобин) имеют четвертичную структуру. Четвертичная структура относится к макромолекулам, в состав которых входит несколько полипептидных цепей. Эта структура соответствует размещению в пространстве полипептидных цепей, не связанных между собой ковалентными связями. Полисахариды – это биополимеры, состоящие из остатков моносахаридов.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 25; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.3.255 (0.167 с.) |







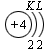
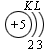
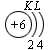


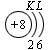
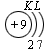

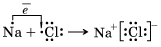

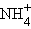 – NH4Cl, (NH4)2SO4, и в солях, образованных органическими основаниями – аминами (например, в хлориде метиламмония – [CH3NH3]+Cl– и т. д.).
– NH4Cl, (NH4)2SO4, и в солях, образованных органическими основаниями – аминами (например, в хлориде метиламмония – [CH3NH3]+Cl– и т. д.).

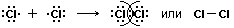



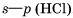

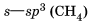
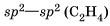


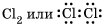
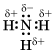

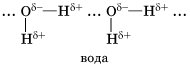
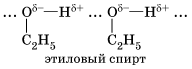
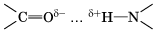
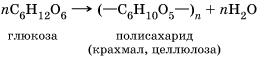
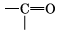 и
и 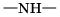 (рис. 3).
(рис. 3).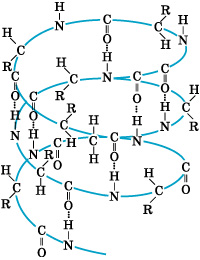
 Рисунок 4.
Рисунок 4.


