Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обратимость химических реакций. Химическое равновесие.
Химические реакции, протекающие в одном направлении, называют необратимыми. Большинство химических процессов являются обратимыми. Это значит, что при одних и тех же условиях протекают и прямая, и обратная реакции (особенно если речь идет о замкнутых системах Например: 1. реакция
в открытой системе необратима; 2. эта же реакция
в замкнутой системе обратима. Рассмотрим более подробно процессы, протекающие при обратимых реакциях, например, для условной реакции
На основании закона действующих масс скорость прямой реакции
Так как со временем концентрации веществ А и В уменьшаются, то и скорость прямой реакции тоже уменьшается. Появление продуктов реакции означает возможность обратной реакции, причем со временем концентрации веществ С и D увеличиваются, а значит, увеличивается и скорость обратной реакции
Рано или поздно будет достигнуто состояние, при котором скорости прямой и обратной реакций станут равными Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием. При этом концентрации реагирующих веществ и продуктов реакции остаются без изменения. Их называют равновесными концентрациями. На макроуровне кажется, что в целом ничего не изменяется. Но на самом же деле и прямой, и обратный процесс продолжают идти, но с равной скоростью. Поэтому такое равновесие в системе называют подвижным или динамическим. Обозначим равновесные концентрации веществ [A], [B], [C], [D]. Тогда, так как
где α, β, γ, δ – показатели степеней, равные коэффициентам в обратимой реакции, K равн – константа химического равновесия. Полученное выражение количественно описывает состояние равновесия и представляет собой математическое выражение закона действующих масс для равновесных систем. При неизмен ной температуре константа равновесия – величина постоянная для данной обратимой реакции. Она показывает соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Состояние равновесия сохраняется сколь угодно долго при неизменных внешних условиях: температуре, концентрации исходных веществ, давлении (если в реакции участвуют или образуются газы).
Изменяя эти условия, можно перевести систему из одного равновесного состояния в другое, отвечающее новым условиям. Такой переход называют смещением или сдвигом равновесия. Рассмотрим разные способы смещения равновесия на примере реакции взаимодействия азота и водорода с образованием аммиака:
|
||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 36; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.105.194 (0.005 с.) |





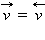
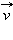 =
= 
 откуда
откуда