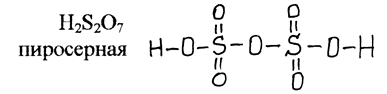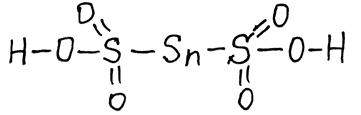Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Качественная реакция на сульфид – ион:⇐ ПредыдущаяСтр 16 из 16
1) осаждение соли CdS –желтого цвета; 2) действие кислоты на сульфид - появляется запах H2S. Оксиды ЭО2, ЭО3. У серы еще S2O3, SO, S2O7, SO4. S + O2 ® SO2 SO2 + H2O «H2SO3 - слабая кислота К1=1.3 ×10-2, К2 = 10-8 SO2 + 1/2O2 ® SO3 DH=-97.5 кДж
ЭО2 - понижается стабильность от S к Se, но повышается к теллуру. У всех оксидов понижается кислотность, возрастают основные свойства. ТеО2 - амфотерный оксид. H2SO4, но H6TeO6 по тем же причинам, что и у иода, слабая кислота. Обилие кислородных кислот серы. Систематизируем. 1) Кислоты с одним атомом серы - H2SO3 и H2SO4. 2) С двумя и более атомами серы очень хороший восстановитель
Политионовые кислоты (сохраняется цепочка атомов серы)
3) Производные перекиси водорода пероксомоносерная пероксодисерная
Из кислот серы важнейшее значение имеет серная кислота. Галогениды и оксогалогениды халькогенов С фтором S + F2 ® SF6; SF4, S2F10 SF6 очень устойчив, хотя SF6+H2O®SO3+6HF DH=-460 кДж, действуют кинетические факторы. Используется как газообразный изолятор. SF4 + H2O ® SO2 + HF, SeF4, TeF4 сильные фторирующие агенты. С хлором образуются только низшие хлориды и оксихлориды: S2Cl2, SCl2. Селен и теллур образуют ЭГ4 - галогенангидриды, которые с солями щелочных металлов образуют комплексы K[SeF5], K2[SeCl6], Cs2[TeI6]. Оксигалогениды: SOCl2 - хлористый тионил; SeOCl2 - селенил. SO2Cl2 - хлористый сульфурил Все они ковалентные соединения, галогенангидриды. Уметь нарисовать геометрию молекул и написать гидролиз. ХИМИЯ ЭЛЕМЕНТОВ V ГРУППЫ Общая электронная формула ns 2 np 3
1) радиус атома увеличивается вниз по группе; 2) металлические свойства усиливаются; 3) энергия ионизации I1 уменьшается; 4) электроотрицательность (ЭО) уменьшается; 5) восстановительные свойства растут вниз по группе; 6) окислительные свойства усиливаются вверх по группе. В пятой группе появляются настоящие металлы Sb, Bi. As - полупроводник. Двухатомная молекула существует только в случае азота - тройная связь, уже для фосфора перекрывание оказывается слишком мало. Фосфор образует три связи, но с разными атомами, его аллотропные модификации P4 - белый фосфор - тетраэдрическая молекула, красный фосфор - соединение тетраэдров, черный фосфор - гофрированные слои, в которых каждый атом связан с тремя другими (знать свойства белого, красного, черного фосфора). У сурьмы и висмута металлические решетки.
Особое значение азота - вся органика, растения, живые организмы - аминосоединения. Инертность азота - DНат= 943 кДж/моль (сравните О2 - 498, F2 - 159). Из металлов азот реагирует только с магнием и литием, образуя нитриды, с неметаллами реагирует только при высоких температурах с катализаторами. Проблема связывания азота. В природе азот переводится в аммиак с помощью фермента нитрогеназа (Знать круговорот азота в природе, процессы аммонификации, нитрификации, денитрификации). Фосфор - содержится в мозге, в скелете 2 кг (26%) Ca3(PO4)2, белки, АТФ, нуклеиновые кислоты. Получение. Ca3(PO4)2 + 3SiO2 +5C = 3CaSiO3 + 5CO + P2(г) DН=3000 кДж Реакция идет при ~2000оС. As2O3 + C ® As + CO2. В кислотах не растворяются, только в кислотах-окислителях P + HNO3(к) ®H3PO4 + NO As+ HNO3(к) ®H3AsO4 + NO Sb + HNO3(к) ® Sb2O5 + NO (кислота не получается, антимонаты есть) Bi + HNO3(к) ® Bi(NO3)3 + NO (указание на понижение стабильности высшей степени окисления - эффект инертной пары. Между валентными электронами и ядром появляется полностью заполненная 4f-оболочка.
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 106; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.171.121 (0.007 с.) |