Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Выводы о свойствах ковалентной связи
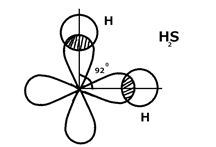
Ковалентная связь обладает тремя свойствами: 1) насыщаемость – атом стремится насытить свои валентные возможности. Например, атом серы в основном состоянии имеет два неспаренных электрона, в молекуле H2S две ковалентных связи.
2) Направленность – если есть хотя бы одна p - орбиталь – связь направленная. 3) Полярность. Количественной мерой полярности служит дипольный момент m, равный произведению величины заряда на длину диполя. m =q· l Где l -длина диполя. Чем больше m, тем более полярна молекула. Полярность молекулы вызвана смещением общей электронной пары к одному из атомов. При этом возникают равные по величине, но противоположные по знаку заряды (d+ и d-), расстояние между которыми (l) называют длиной диполя. В ряду сходных молекул m возрастает по мере увеличения разности ЭО.
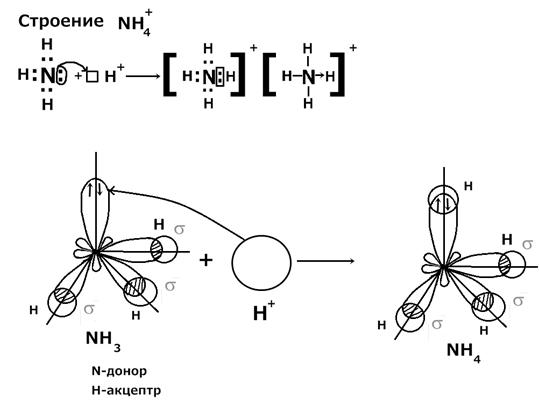
Донорно-акцепторная связь Донорно-акцепторная связь - это связь, которая образуется за счет неподеленной электронной пары одного атома (донора) и свободной орбитали другого элемента (акцептора). Примеры: строение NH4+, H3O+
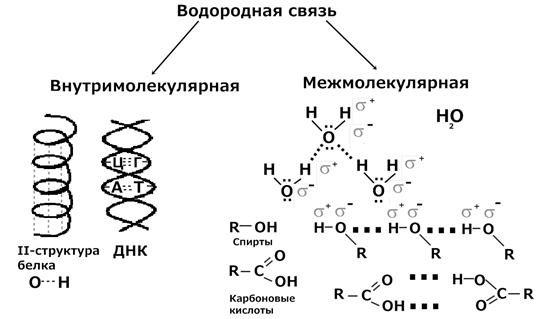
Водородная связь Водородная связь – это связь, между атомами водорода и сильно электроотрицательными элементами: О, N, P, F и т.д. Водородная связь бывает двух видов: внутримолекулярная и межмолекулярная
Природа водородная связи: водородная связь образуется за счет двух составляющих: электростатического притяжения и донорно-акцепторного взаимодействия: О – донор, Н – акцептор. Энергия водородной связи (20-30 Дж/моль) меньше, чем энергия ковалентной связи (360-400 кДж/моль) примерно в 10 раз. Признак наличия водородной связи в соединении – аномально высокая температура кипения.
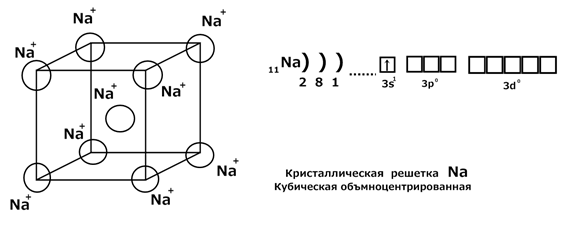
III Металлическая связь Металлическая связь – это связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке. Рассмотрим природу металлической связи на примере металлического Na. В узлах кристаллической решетки находятся ионы металла Na +, а электроны свободно омывают кристаллическую решетку, образуя «электронный газ». Такой вид связи характерен для металлов в твердом и жидком состояниях, в парах между атомами металла обычная ковалентная связь.
Таким типом связи объясняются электропроводность, теплопроводность и пластичность металлов. Поведение электронов металла описывает физика твердого тела
Комплексные соединения Все химические соединения можно разделить на 2 большие группы: 1. Соединения 1-го рода. Атомы соединены за счет химических связей (H2O, CuSO4, …)
2. Соединения 2-го рода (высшего порядка, комплексные соединения). Они образуются из соединений первого рода за счет донорно-акцепторной связи. Комплексные соединения это соединения, которые невозможно описать с позиций обычной валентности или степеней окисления. Их очень много и они разнообразны хотя бы по цвету: Co2+ + 6CH3COO- «[Co(CH3COO)6]4- розовый Co2+ + 6NO2- «[Co(NO2)6]4- оранжевый Co2+ + 4Cl- «[CоCl4]2- синий Сo2+ + 4SCN- «[Co(SCN)4]2- фиолетовый Эти соединения могут содержать не только ионы, но и молекулы: Cu2+ + 4NH3 «[Cu(NH3)4]2+ синий Ni2+ + 6NH3 «[Ni(NH3)6]2+ фиолетовый В чем причина существования таких необычных соединений, за счет чего осуществляется химическая связь в них? Впервые теорию комплексных соединений предложил швейцарский химик Вернер в 1893г.
|
|||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 94; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.181.81 (0.005 с.) |