Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Неполярная ковалентная связь
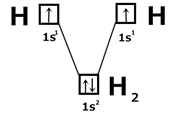
Образуется при соединении атомов с одинаковыми значениями ЭО. Это молекулы H 2, F 2, Cl 2, N 2, O 2 и др. Химическая связь образуется за счет общих электронных пар, путем перекрывания электронных облаков.
Как изображают химическую связь(рассмотрим на примере молекулы H 2): 1) с помощью структурных формул Н – Н (предложил А.М. Бутлеров 1869 г) 2) с помощью электронных формул Н∙ + Н∙ → Н:Н (Льюис, Коссель 1916г) 3) с помощью квантовых ячеек (Лондон, Гейтлер 1927г)
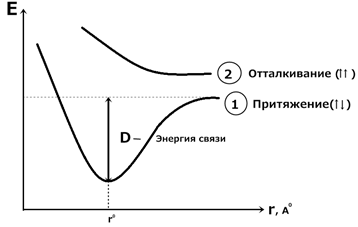
Лондон и Гейтлер развили представления Льюиса. С точки зрения квантовой механики молекула H 2 образуется за счет парыэлектроновс антипараллельными спинами. Молекула водорода состоит из двух ядер и двух электронов. При сближении атома возникают силы притяжения и отталкивания. Устойчивое состояние: когда силы притяжения уравновешивают силы отталкивания. Это состояние отвечает определенной длине связи.
Рис. 4.1 Изменение энергии при сближении атомов водорода. (1): Н↑ + Н↓ → Н ↑↓Н притяжение (2): Н↑ + Н↑ → Н ↑↑Н отталкивание 4) Метод валентных связей (Лайнус Полинг, Слейтер 30-е годы 20-го века). Простую одинарную связь образуют 2 электрона с антипараллельными спинами, принадлежащие двум атомам. При образовании связей происходит перекрывание орбиталей валентных электронов. Связь располагается в том направлении, в котором возможность перекрывания орбиталей является наибольшей. Из двух орбиталей более прочную связь образует та, которая сильнее перекрывается орбиталью другого атома.
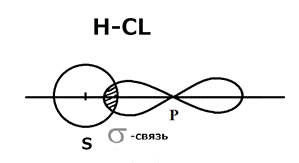
σ -Сигма связь образуется по линии, соединяющие центры атома. Связь прочная. Связь S-S электронов в молекуле H 2 ненаправленная, р-р электронов в молекуле Cl 2 направленная, в 3 раза сильнее связи S-S. π - Пи свзязь образуется в направлении, перпендикулярном линии, соединяющей центры атомов (двухцентровая связь. π - связь более слабая, чем σ). Строение молекулы N 2:
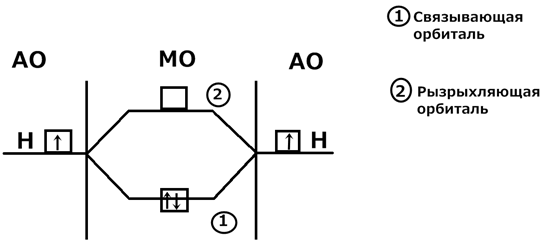
Метод МО ЛКАО (молекулярные орбитали линейная комбинация атомных орбиталей) (Роберт Малликен, 30-40 г XXв, Нобелевская премия – 1966г) Постулаты метода: 1) При образовании ковалентных связей между атомами из их атомных орбиталей (АО) образуются молекулярные орбитали (МО). Число МО равно числу АО, участвующих в их образовании.
2) МО делятся на связывающие и разрыхляющие. Энергия связывающих орбиталей меньше энергии АО, а энергия разрыхляющих больше энергии АО. 3) МО бывает двух типов: π и σ (пи, сигма) 4) Электроны заполняют МО как и АО в соответствии с принципом Паули, правила Хунда и принципом наименьшей энергии. 5) Молекула будет устойчивой, если число электронов на связывающих МО больше числа электрона на разрыхляющих МО. Строение молекулы Н2 методом МО ЛКАО:
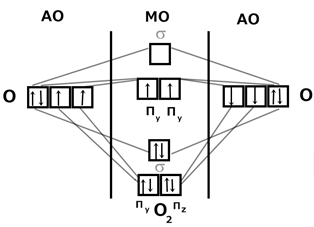
Молекула кислорода парамагнитна, втягивается в магнитное поле. Молекула O 2 имеет два неспаренных электрона. Строение молекулы O 2 было объяснено только методом МО ЛКАО. Строение молекулы O 2 методом МО ЛКАО:
Полярная ковалентная связь Образуется при взаимодействии атомов, ЭО которых отличается незначительно, например молекула Н Сl Н ЭО-2.1; Сl ЭО-2.89
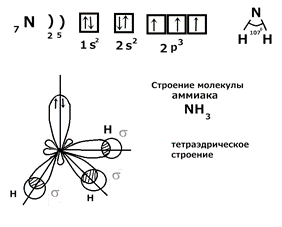
Лайнус Полинг показал, что при образовании связи может происходить sp 3, sp 2 и sp гибридизация. Гибридизация – это выравнивание электронных облаков по форме и энергии, с целью достижения максимального перекрывания при образовании химической связи. 1) Примеры sp 3 гибридизации: молекулы CH4, H2O, NH3, SiH4, PH3. В пространстве гибридные sp 3 облака направлены к вершинам тетраэдра. Тетраэдрический угол 109◦28 в молекуле CH 4. Рассмотрим строение молекулы NH 3:
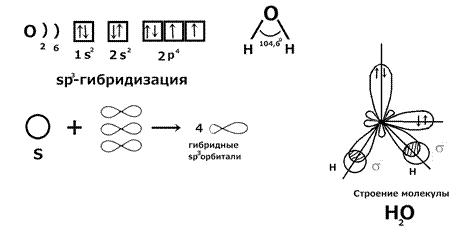
Строение молекулы H 2 O: сжатие угла связанно с увеличением числа неподеленных электронных пар.
Вывод: молекулы в sp 3 гибридизации имеют тетраэдрическое строение. 2) Пример sp 2 гибридизации: BCl 3.
В пространстве гибридные sp 2 орбитали располагаются в одной плоскости под углом 120 градусов, а негибридная p -орбиталь располагается перпендикулярно этой плоскости
3) Пример sp гибридизации: Be Cl 2
В пространстве гибридные sp – орбитали располагаются по прямой, а две негибридные p –орбитали располагаются перпендикулярно этой прямой.
|
|||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 104; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.82.79 (0.006 с.) |