
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчеты рН кислот и оснований
Рассмотрим 4 возможных случая: 1. Сильная кислота – НCl, HNO3, H2SO4, HClO4 и др. HАn <=> H+ + An- диссоциация идет практически нацело. [H+] = C кислоты рН = - ℓ g [ H + ] = - ℓ g C кислоты
2. Слабая кислота – H2S, HCN, H2CO3, HNO2, H2SO3 и др. HАn <=> H+ + An- диссоциация идет слабо, меньше 5% [H+] ≠ С кислоты [H+] = √Kдис ∙ C pH = 1/2 pK а – 1/2 ℓ g C кислоты pK а- силовой показатель кислоты; pK а= -ℓg Kдис к-ты
3. Сильное основание (щелочи) LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2 MeOH <=> Me+ + OH- диссоциация идет полностью. [ОН-] = C основания p[OH-] = - ℓg[OH-] = -ℓg C основания рН = 14 – p[OH-] = 14 + ℓg C основания
4. Слабое основание: NH4OH MeOH <=> Me+ + OH- диссоциация идет не полностью, меньше 5% [OH-] ≠ С основания [OH-] = √ Kдис ∙ C pH = 14 – 1/2 рКв + 1/2 ℓg Cоснования pKв – силовой показатель основания; pKв= -ℓg Kдис осн Качественно кислотность среды определяется с помощью индикаторов – веществ, которые меняют свою окраску в зависимости от характера среды. Наиболее распространёнными индикаторами являются: метиловый оранжевый, метиловый красный, фенолфталеин. В таблице даны характеристики основных применяемых индикаторов. Таблица 1. Кислотно-основные индикаторы
Более точно измерение pH среды проводят с помощью приборов pH –метров. Для многих агрохимических процессов кислотность среды имеет большое значение. Например, pH почвенного раствора – важнейшая характеристика почвы. Растения нормально произрастают только при определенных значениях pH почвенного раствора.
Буферные растворы Способность некоторых растворов сохранять постоянное значение рН при добавлении небольших количеств кислот и щелочей называют буферным действием.
Буферные растворы – это растворы с определенной концентрацией свободных водородных ионов (рН), которые незначительно изменяются при разбавлении, концентрировании а так же при добавлении небольших количеств кислот и щелочей, не превышающих некоторых пределов.
Примеры буферных растворов:
1. Растворы, содержащие слабую кислоту и её соль, образованную сильным основанием. СН3СООН + СН3СООNa – ацетатный буфер 2. Растворы, содержащие слабое основание и его соль образованную сильной кислотой. NH4OH + NH4Cl – аммиачный буфер (аммонийный буфер) 3. Растворы, содержащие смесь кислых солей NaH2PO4 + Na2HPO4 – фосфатный буфер. NaHCO3 + Na2CO3 – карбонатный буфер. В расчетах менее замещенная соль играет роль кислоты. РН буферных растворов I. Рассчитаем рН буферного раствора на примере ацетатного буфера: СН3СООН + СН3СООNa СН3СООН <=> CH3COO- + H+ Kдис = [CH3COO-] ∙ [H+] / [CH3COOH] [H+] = Kдис ∙ [CH3COOH] / [CH3COO-] [CH3COOH] = C кислоты [CH3COO-] = C соли -lg[H+] = - lg Kдис – lg C кислоты / С соли рН = рКа – lg C кислоты /С соли Если соль и кислота взяты в разных объемах, то формула имеет следующий вид: рН = рКа – lg (C кислоты ∙ V кислоты) / (C соли ∙ V соли) С - молярная концентрация эквивалента. рКа – силовой показатель кислоты II. Для аммиачного буфера: рН = 14 – рКв + lg (C кислоты ∙ V кислоты) / (C соли ∙ V соли) рКв – силовой показатель основания. Наиболее часто применяют буферные растворы с концентрацией компонентов 0.1 н. Механизм буферного действия Буферное действие этих растворов объясняется их способностью связывать как ионы Н+, так и ОН-. Пример ацетатного буфера: a) Добавляем кислоту: СН3COONa + HCl → C H3COOH + NaCl CH3COO- + Na+ + H+ + Cl- → CH3COOH + Na+ + Cl- CH3COO- + H+ → CH3COOH Добавили сильную кислоту, получилась слабая кислота, рН не изменится. в) Добавляем щелочь: СH3COOH + NaOH → CH3COONa + H2O CH3COOH + Na+ + OH- → CH3COO- + Na+ + H2O CH3COOH + OH- → CH3COO- + H2O Добавили сильную щелочь, получился слабый электролит – вода, рН не изменится. 2. Пример аммиачного буфера: a) Добавляем кислоту: NH4OH + HCl → NH4Cl + H2O NH4OH + H+ + Cl- → NH4+ + Cl- + H2O NH4OH + H+ → NH4++H2O Добавили кислоту, получился слабый электролит – вода, рН не изменится.
в) Добавляем щелочь: NH4Cl + NaOH → NH4OH + NaCl NH4+ + Cl- + Na+ + OH- → NH4OH + Na+ + Cl- NH4+ + OH- → NH4OH Добавили щелочь, получился слабый электролит гидроксид аммония, рН не изменится. Вывод: таким образом, способность буферного раствора поддерживать практически постоянной величину рН основана на том, что один компонент раствора связывает ионы [Н+], а другой [ OH -] Разбавление буферного раствора или его концентрирование путём выпаривания не влияет на pH, т.к. при этом меняется концентрация компонентов буфера, но их отношение остается неизменным. Буферная ёмкость Способность буферных растворов сохранять постоянство pH небезгранична. Предел, в котором проявляется буферное действие называется буферной ёмкостью (B). Она определяется количеством эквивалентов сильной кислоты или щелочи, которое надо добавить к 1 литру буферного раствора, чтобы его pH изменился на 1.
где Буферная ёмкость тем выше, чем больше концентрация компонентов буферного раствора. Наибольшей буферной емкостью обладают растворы с одинаковой концентрацией компонентов. В таких растворах всегда
|
|||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 68; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.33.41 (0.009 с.) |
||||||||||||||||||||||||||||||||||||||||||
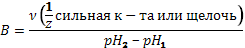
 исходное значение,
исходное значение,  значение после добавления щелочи или кислоты.
значение после добавления щелочи или кислоты. или
или  . Разбавление буферного раствора не влияет на его pH, но сильно сказывается на его буферной ёмкости, она уменьшается.
. Разбавление буферного раствора не влияет на его pH, но сильно сказывается на его буферной ёмкости, она уменьшается.


