
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекции по неорганической химииСтр 1 из 16Следующая ⇒
Лекции по неорганической химии для студентов очного отделения факультета лесного хозяйства План лекций 1. Скорость химической реакции. Химическое равновесие. 2. Растворы. Протолитические процессы и равновесия. 2.1 Классификация растворов. Тепловые и объемные эффекты. 2.2 Электролитическая диссоциация. Сильные и слабые электролиты. 2.3 Сильные электролиты. Теория Дебая - Хюккеля. 2.4 Теория кислот и оснований по Бренстеду – Лоури. 2.5 Ионное произведение воды. Водородный и гидроксильный показатель. 2.6 Буферные растворы 2.7 Гидролиз солей 3. Строение атома. Периодический закон 4. Химическая связь 5. Комплексные соединения 6. Окислительно - восстановительные реакции. 7.Редокспотенциалы и направление протекания окислительно- восстановительных реакций. 8.Химия биогенных элементов и их соединений. 8.1 Химия элементов VI группы. Халькогены. 8.2 Химия элементов V группы.
Скорость химической реакции. Химическое равновесие Раздел химии, изучающий скорость химических реакций и механизмы их протекания называется химической кинетикой. Все реакции протекают во времени. Одни идут очень быстро (взрывы, горение), другие медленно (формирование горных пород). Но все реакции подчиняются общим законам. Все реакции можно разделить на две группы: 1. Гомогенные – реагирующие вещества находятся в одной фазе – газообразной или жидкой. N2 + 3H2 → 2NH3 2. Гетерогенные – реагирующие вещества находятся в разных фазах Газ – твердое тело Жидкость – Твердое тело Газ – жидкость С + O2 → CO2 Рассмотрим в общем виде химическую реакцию и изменение концентраций реагирующих веществ со временем: А + В → C + D Где: A и В – исходные вещества, С и D – продукты. За скоростью реакции можно следить по изменению концентрации любого вещества, как по исходному, так и по продуктам.
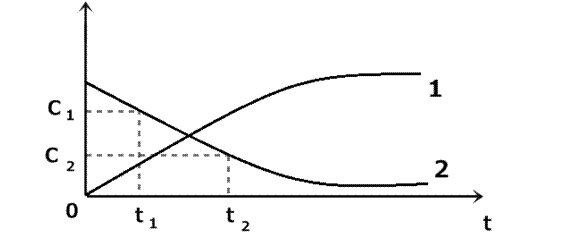
Рис. 1 Зависимость изменения концентрации продуктов (1) и исходных веществ (2) от времени. Допустим, мы следим за скоростью реакции по исходному веществу. В какой - то момент времени t 1 ему будет соответствовать концентрация С1, а моменту времени t 2 будет соответствовать концентрация С2. Тогда средняя скорость реакции будет описываться уравнением:
V ср = - С2 - С1/ t 2 - t 1 или: V ср = - ∆С/∆ t « -», еслирасчет ведется по исходным веществам; «+», расчет ведется по продуктам реакции. Истинная скорость реакции: V ист = - dC / dt I. Влияние природы реагирующих веществ Все вещества реагируют с разной скоростью, но иногда можно выделить реакционные серии, например взаимодействие щелочных металлов с водой: 2 H 2 O + 2 Me →2 M е OH + H 2 Здесь химизм процесса – перенос электрона от металла к иону водорода. С Li – реакция идет медленно, Na – загорается, K – легче всего отдает электрон, реакция идет со взрывом. II. Влияние концентрации Пустьпроцесс превращения выражается уравнением: аА + bB → cC + dD где d, b, c, d – стехиометрические коэффициенты. Тогда скорость реакции выражается уравнением V = k [ A ] a × [ B ] b [A] и ×[B] – текущие концентрации веществ А и В. Это уравнение называется основным законом химической кинетики, или законом действующих масс (открыт К. Гульбергом и П. Вааге в1867 г.) Его формулировка: Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степени их коэффициентов. Здесь k - константа скорости реакции. Физический смысл k – она численно равна скорости при концентрации реагирующих веществ равной 1 моль/л. k зависит только от природы реагента и температуры не зависит от концентрации. Показатель степени, в который входит концентрация в уравнении для скорости называется порядком реакции. Например для реакции синтеза аммиака: N 2 + 3 H 2 → 2 NH 3 Порядок реакции по N2 – 1, по Н2 – 3, общий порядок реакции – 4 Кинетические уравнения получают экспериментально, порядок реакции может не совпадать со стехиометрическими коэффициентами. III. Влияние температуры В небольшом интервале температур достаточно точным является правило Вант – Гоффа: При повышении температуры на 10 градусов скорость реакции увеличивается в 2 – 4 раза. Vt 2 = Vt 1 g t 2 - t 1 /10 g ( гамма) – температурный коэффициент реакции, он показывает, во сколько раз изменится скорость реакции при повышении температуры на 10 градусов. Vt 1 - скоростьпри температуре t 1, Vt 2 - скоростьпри температуре t 2.
Температурный коэффициент для разных реакций различен. При обычных температурах его значение для большинства реакций лежит в пределах от 2 до 4. Для более широкого интервала температур зависимость константы скорости k от температуры описывается уравнением Аррениуса (1889 г.): k = k 0 × e - Ea / RT или в логарифмической форме: lnk = lnk 0 - Ea / RT, где k 0 - предэкспоненциальный множитель, имеющий смысл максимально возможного значения константы скорости при нулевой энергии активации или бесконечно высокой температуре, когда все столкновения молекул реагентов становятся активными. k – константа скорость реакции; R - универсальная газовая постоянная, равная 8,31 Дж/моль×К; e – основание натурального логарифма; T – температура в градусах Кельвина; Еа – энергия активации, Дж/моль. Влияние температуры на скорость реакции объясняет теория активации. Не все соударения молекул приводят к взаимодействию, а только эффективные, с образованием активных молекул, обладающих энергией, достаточной для взаимодействия (Еа). Энергия активации, это минимальная энергия, которой должна обладать система, что бы произошло взаимодействие. Пусть мы имеем реакцию: А + B → C + D. Изменение энергии такой системы выражается графиком, представленным на рис.2.
Рис.2 Зависимость энергии системы от координаты реакции. (Еа1- энергия активации каталитической реакции) АК(активированный комплекс) – неустойчивое образование, в котором ослабляются и удлиняются связи, разрываемые в ходе реакции. Рассмотрим на примере реакции: H2 + Cl2 → 2HCl H Cl H - - - - Cl H – Cl | + | → | | → H Cl H - - - - Cl H – Cl Исходные вещества Активированный Продукты реакции комплекс Координата реакции - это путь от исходного состояния в конечное через активированный комплекс Еа различных реакций различна. Посредством этого фактора сказывается влияние природы реагирующих веществ на скорость реакции. Если Еа<40 кДж/моль (т.е. мала), то скорость такой реакции велика (например, ионные реакции в растворах и радикальные реакции протекают практически мгновенно). Если Еа>120 кДж/моль (т.е. очень значительна), то скорость такой реакции незначительна (например, реакция синтеза аммиака N2+3H2=2NH3 – скорость этой реакции при обычных температурах вследствие высоких значений Еа настолько мала, что заметить её протекание практически невозможно). Ферментативный катализ Все биохимические процессы в живой природе проходят с участием ферментов (Ф). Ф – катализаторы белковой природы. В настоящее время известно порядка 2000 ферментов, которые классифицируют по типу катализируемой реакции. Особенности ферментативного катализа: 1. Строение ферментов. Он состоит из третичной структуры белка – глобулы, и имеет один активный центр, который занимает небольшую часть молекулы. 2. Высокая специфичность. Один фермент катализирует превращение одного вещества или одного типа реакций. 3. Принцип структурного соответствия – фермент – субстрат: «ключ и замок», «рука и перчатка» (рис.3) 4. Ферменты, осуществляют превращения в несколько стадий с низкими энергиями активации.
5. Ферменты работают при обычном давлении и низких температурах. 6. Высокая эффективность. Скорость ферментативной реакции в 103 – 1012 степени раз больше скорости обычных реакций. Пример: H2O2 → H2O + O Ф – каталаза за минуту расщепляет 5 миллионов молекул. 7. Работа фермента зависит от рН среды Сельскохозяйственные продукты хранят при пониженных температурах, так как охлаждение замедляет нежелательные ферментативные процессы. Химическое равновесие. Принцип Ле –Шателье Химические реакции можно разделить на две группы: 1. Необратимые (получаются: осадок, газ, вода, слабый электролит) 2. Обратимые – реакции, которые могут протекать как в прямом, так и в обратном направлениях. SO2 + H2O <=> H2SO3 Рассмотрим обратимую реакцию: aA +bB <=> cC + dD Пусть: V1 – скорость прямой реакции; V2 – скорость обратной реакции Скорости прямой и обратной реакций связаны с концентрациями реагентов следующими уравнениями: V1 = k1 [ A ] a × [ B ] b и V2 = k2 [ C ] c × [ D ] d [ ] – равновесная концентрация реагентов. С течением времени скорость прямой реакции будет уменьшаться вследствие расхода реагентов А и В и понижения их концентраций. Напротив, скорость обратной реакции по мере накопления продуктов С и D будет возрастать. Поэтому через некоторый промежуток времени скорости прямой и обратной реакций сравняются друг с другом (рис.4). Если на систему, находящуюся в равновесии произвести какое-либо внешнее воздействие (изменить T, P и С), то равновесие смещается в сторону той из двух противоположных реакций, которая уменьшает данное воздействие Правила смещения равновесия 1) Повышение температуры смещает равновесие в сторону эндотермической реакции, а понижение в сторону экзотермической. 2) Рост давления вызывает сдвиг равновесия в сторону реакции, идущей с уменьшением числа молей газообразных продуктов. 3) Увеличение концентрации исходных веществ вызывает сдвиг равновесие вправо. 4) Увеличение концентрации продуктов реакции вызывает сдвиг равновесие влево. Например, для реакции синтеза аммиака: N2 + 3H2 <=> 2NH3 + Q 1. T растет, равновесие смещается влево. 2. Р растет, равновесие смещается вправо. 3. С исходных веществ растет, равновесие сдвигается вправо. 4. С продуктов растет, равновесие сдвигается влево. Для реакции N2 + O2 <=> 2NO – Q 1. T растет, равновесие смещается вправо.
2. Р не влияет. Водородный показатель (рН) В 1909г. Соренсен для удобства расчетов ввел величину: pH = – ℓ g [ H + ], отсюда [ H + ] = 10- pH Буферные растворы Способность некоторых растворов сохранять постоянное значение рН при добавлении небольших количеств кислот и щелочей называют буферным действием. Буферные растворы – это растворы с определенной концентрацией свободных водородных ионов (рН), которые незначительно изменяются при разбавлении, концентрировании а так же при добавлении небольших количеств кислот и щелочей, не превышающих некоторых пределов.
Примеры буферных растворов:
1. Растворы, содержащие слабую кислоту и её соль, образованную сильным основанием. СН3СООН + СН3СООNa – ацетатный буфер 2. Растворы, содержащие слабое основание и его соль образованную сильной кислотой. NH4OH + NH4Cl – аммиачный буфер (аммонийный буфер) 3. Растворы, содержащие смесь кислых солей NaH2PO4 + Na2HPO4 – фосфатный буфер. NaHCO3 + Na2CO3 – карбонатный буфер. В расчетах менее замещенная соль играет роль кислоты. РН буферных растворов I. Рассчитаем рН буферного раствора на примере ацетатного буфера: СН3СООН + СН3СООNa СН3СООН <=> CH3COO- + H+ Kдис = [CH3COO-] ∙ [H+] / [CH3COOH] [H+] = Kдис ∙ [CH3COOH] / [CH3COO-] [CH3COOH] = C кислоты [CH3COO-] = C соли -lg[H+] = - lg Kдис – lg C кислоты / С соли рН = рКа – lg C кислоты /С соли Если соль и кислота взяты в разных объемах, то формула имеет следующий вид: рН = рКа – lg (C кислоты ∙ V кислоты) / (C соли ∙ V соли) С - молярная концентрация эквивалента. рКа – силовой показатель кислоты II. Для аммиачного буфера: рН = 14 – рКв + lg (C кислоты ∙ V кислоты) / (C соли ∙ V соли) рКв – силовой показатель основания. Наиболее часто применяют буферные растворы с концентрацией компонентов 0.1 н. Механизм буферного действия Буферное действие этих растворов объясняется их способностью связывать как ионы Н+, так и ОН-. Пример ацетатного буфера: a) Добавляем кислоту: СН3COONa + HCl → C H3COOH + NaCl CH3COO- + Na+ + H+ + Cl- → CH3COOH + Na+ + Cl- CH3COO- + H+ → CH3COOH Добавили сильную кислоту, получилась слабая кислота, рН не изменится. в) Добавляем щелочь: СH3COOH + NaOH → CH3COONa + H2O CH3COOH + Na+ + OH- → CH3COO- + Na+ + H2O CH3COOH + OH- → CH3COO- + H2O Добавили сильную щелочь, получился слабый электролит – вода, рН не изменится. 2. Пример аммиачного буфера: a) Добавляем кислоту: NH4OH + HCl → NH4Cl + H2O NH4OH + H+ + Cl- → NH4+ + Cl- + H2O NH4OH + H+ → NH4++H2O Добавили кислоту, получился слабый электролит – вода, рН не изменится. в) Добавляем щелочь: NH4Cl + NaOH → NH4OH + NaCl NH4+ + Cl- + Na+ + OH- → NH4OH + Na+ + Cl- NH4+ + OH- → NH4OH Добавили щелочь, получился слабый электролит гидроксид аммония, рН не изменится. Вывод: таким образом, способность буферного раствора поддерживать практически постоянной величину рН основана на том, что один компонент раствора связывает ионы [Н+], а другой [ OH -] Разбавление буферного раствора или его концентрирование путём выпаривания не влияет на pH, т.к. при этом меняется концентрация компонентов буфера, но их отношение остается неизменным.
Буферная ёмкость Способность буферных растворов сохранять постоянство pH небезгранична. Предел, в котором проявляется буферное действие называется буферной ёмкостью (B). Она определяется количеством эквивалентов сильной кислоты или щелочи, которое надо добавить к 1 литру буферного раствора, чтобы его pH изменился на 1.
где Буферная ёмкость тем выше, чем больше концентрация компонентов буферного раствора. Наибольшей буферной емкостью обладают растворы с одинаковой концентрацией компонентов. В таких растворах всегда Гидролиз солей Гидролизом солей называется обменная реакция ионов соли с молекулами воды, в результате которой смещается равновесие диссоциации воды и часто изменяется рН растворов. Согласно современным представлениям о механизме диссоциации ионы в водном растворе окружены гидратной оболочкой. Катионы удерживают свою гидратную оболочку за счет донорно-акцепторной связи.
Katz+ ← О
Анионы удерживают свою гидратную оболочку за счет водородной связи:
Н Исходя из этого, гидролиз является результатом поляризационного взаимодействия ионов соли с их гидратной оболочкой. Гидролизу подвергаются соли, образованные: 1. слабым основанием и сильной кислотой; 2. сильным основанием и слабой кислотой; 3. слабой кислотой и слабым основанием; 4. соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются I. Под действием электрического поля иона соли в молекуле воды происходит перераспределение зарядов, и молекула воды становится более полярной, связи в ней разрываются. Этот процесс для катионов можно представить так:
Н Представленная схема имеет место при гидролизе соли по катиону (соли образованы слабыми основаниями и сильными кислотами). Существуют соли: а) однозарядных катионов NH4+, Cu+; б) двухзарядных Си2+, Zn2+, Cd2+, Mn2+... в) трехзарядных А13+, Cr3+, Fe3+; Пример: Рассмотрим гидролиз соли хлорида цинка. Так как катион Zn2+ двухзарядный, гидролиз идет ступенчато. По второй ступени гидролиз идет незначительно. 1ступень: Ионное уравнение: Zn2+ + Н2О <=> (ZnOH)+ + Н+ Молекулярное уравнение: ZnCl2 + Н2О <=> ZnOHCl + HC1 2ступень: ZnOH+ + Н2О <=> Zn(OH)2 + Н+ ZnOHCl + Н2О <=> Zn(OH)2 + HCl Ионное уравнение показывает: а) гидролизу подвергся катион Zn2+ б) в результате реакции гидролиза накапливаются ионы Н+, которые сообщают среде кислую реакцию (рН<7). II. Гидролиз по аниону (соли образованы сильными основаниями и слабыми кислотами). Взаимодействие силового поля анионов с гидратной оболочкой:
Н Существуют соли: а) однозарядных анионов CN ¯, СlO ¯ б) двухзарядных анионов S2-, SO32-, СО3 2- б) трехзарядных анионов ВО33-, СrО33- Пример: Рассмотрим гидролиз соли Na2S. Анион S2- двухзарядный, поэтому идет двухступенчатый гидролиз: 1 ступень: 2 ступень: S2- + Н2О <=> HS- + ОН- HS- + Н2О<=>H2S + ОН- Na2S + Н2О <=> NaHS + NaOH NaHS + Н2О <=> H2S + NaOH Ионные уравнения показывают, что: а) гидролизу подвергаются анионы S2- б) в результате гидролиза накапливаются ионы ОН-, которые сообщают среде щелочную реакцию рН > 7. Значение гидролиза Гидролиз в широком смысле – это реакция обменного характера между различными веществами и водой. Он широко распространен в природе: 1. Гидролиз белков, жиров, углеводов. 2. Гидролиз неорганических веществ – карбидов, галогенидов. 3. рН плазмы крови поддерживается постоянным за счет реакций гидролиза: HCO3- +HOH <=> H2CO3 + OH- HP О 4 2- + H2O<=> H2P О 4 - + OH- 4. В больших масштабах применяется гидролиз солей Na3PO4 и Na2CO3 для очистки воды и уменьшения её жесткости. 5. В результате гидролиза минералов происходит разрушение горных парод. 6. В промышленности осуществляется гидролиз древесины, хлопковой шелухи, подсолнечной лузги, соломы, в результате чего из не пищевых продуктов получают этанол, белковые дрожжи, глюкозу и т.д. 7. Гидролиз солей, содержащихся в почве, сильно влияет на ее кислотность. Целый ряд удобрений относится к солям, гидролиз их также сказывается на кислотности почвы. Спиновая теория валентности Понятие валентности было введено в 1853г английским ученым Франкландом. Валентность элемента – это число химических связей, которые атом данного элемента образует с другими атомами в данной молекуле. Согласно современным представлениям валентность элемента определяется тремя факторами: 1) числом неспаренных электронов; 2) наличием свободных орбиталей и возможностью распаривания электронов; 3) наличием неподеленных электронных пар на внешнем уровне и возможностью донорно-акцепторного взаимодействия. Рассмотрим на примере серы:
Сера в основном состоянии имеет валентность II, в возбужденном IV и VI. Виды химической связи Учение о химической связи – центральный вопрос современной химии. Без него нельзя понять причину многообразия химических соединений, механизма их образования, строения и реакционной способности. Показатель, какая связь образуется между атомами – электроотрицательность элементов (ЭО).
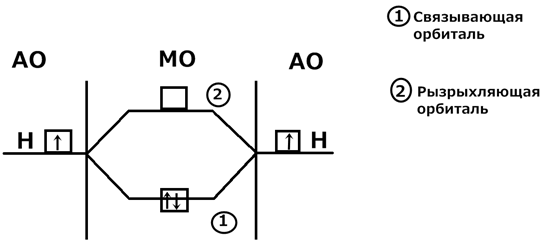
Виды связи: I. Ионная – образуется при взаимодействии атомов которые сильно отличаются по электроотрицательности. Типичная ионная связь, это связь между металлами 1-й и 2-й группы и галогенами и кислородом. Связь осуществляется за счет электростатического притяжения. Li 0 – e = Li + (электронная конфигурация инертного газа He) F 0 + e = F - (электронная конфигурация инертного газа Ne) Ионы Li + и F - притягиваются за счет сил электростатического притяжения. Соединения с ионной связью обладают высокими температурами плавления. II. Ковалентная связь Метод МО ЛКАО (молекулярные орбитали линейная комбинация атомных орбиталей) (Роберт Малликен, 30-40 г XXв, Нобелевская премия – 1966г) Постулаты метода: 1) При образовании ковалентных связей между атомами из их атомных орбиталей (АО) образуются молекулярные орбитали (МО). Число МО равно числу АО, участвующих в их образовании. 2) МО делятся на связывающие и разрыхляющие. Энергия связывающих орбиталей меньше энергии АО, а энергия разрыхляющих больше энергии АО. 3) МО бывает двух типов: π и σ (пи, сигма) 4) Электроны заполняют МО как и АО в соответствии с принципом Паули, правила Хунда и принципом наименьшей энергии. 5) Молекула будет устойчивой, если число электронов на связывающих МО больше числа электрона на разрыхляющих МО. Строение молекулы Н2 методом МО ЛКАО:
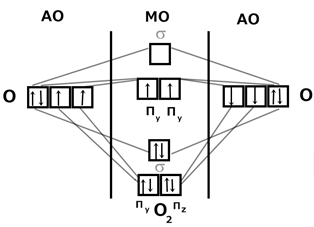
Молекула кислорода парамагнитна, втягивается в магнитное поле. Молекула O 2 имеет два неспаренных электрона. Строение молекулы O 2 было объяснено только методом МО ЛКАО. Строение молекулы O 2 методом МО ЛКАО:
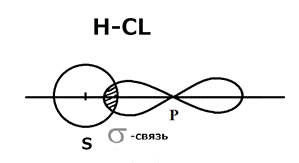
Полярная ковалентная связь Образуется при взаимодействии атомов, ЭО которых отличается незначительно, например молекула Н Сl Н ЭО-2.1; Сl ЭО-2.89
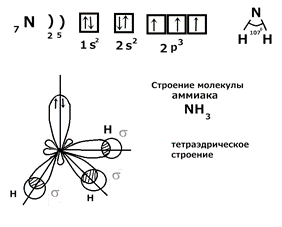
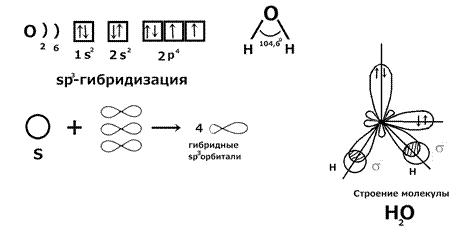
Лайнус Полинг показал, что при образовании связи может происходить sp 3, sp 2 и sp гибридизация. Гибридизация – это выравнивание электронных облаков по форме и энергии, с целью достижения максимального перекрывания при образовании химической связи. 1) Примеры sp 3 гибридизации: молекулы CH4, H2O, NH3, SiH4, PH3. В пространстве гибридные sp 3 облака направлены к вершинам тетраэдра. Тетраэдрический угол 109◦28 в молекуле CH 4. Рассмотрим строение молекулы NH 3:
Строение молекулы H 2 O: сжатие угла связанно с увеличением числа неподеленных электронных пар.
Вывод: молекулы в sp 3 гибридизации имеют тетраэдрическое строение. 2) Пример sp 2 гибридизации: BCl 3.
В пространстве гибридные sp 2 орбитали располагаются в одной плоскости под углом 120 градусов, а негибридная p -орбиталь располагается перпендикулярно этой плоскости
3) Пример sp гибридизации: Be Cl 2
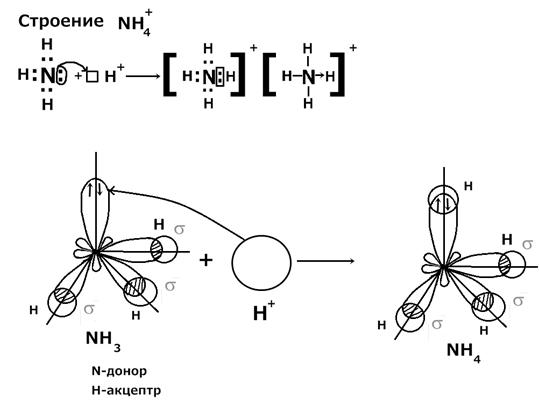
В пространстве гибридные sp – орбитали располагаются по прямой, а две негибридные p –орбитали располагаются перпендикулярно этой прямой. Донорно-акцепторная связь Донорно-акцепторная связь - это связь, которая образуется за счет неподеленной электронной пары одного атома (донора) и свободной орбитали другого элемента (акцептора). Примеры: строение NH4+, H3O+
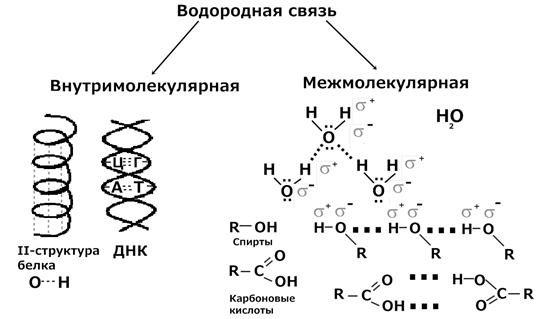
Водородная связь Водородная связь – это связь, между атомами водорода и сильно электроотрицательными элементами: О, N, P, F и т.д. Водородная связь бывает двух видов: внутримолекулярная и межмолекулярная
Природа водородная связи: водородная связь образуется за счет двух составляющих: электростатического притяжения и донорно-акцепторного взаимодействия: О – донор, Н – акцептор. Энергия водородной связи (20-30 Дж/моль) меньше, чем энергия ковалентной связи (360-400 кДж/моль) примерно в 10 раз. Признак наличия водородной связи в соединении – аномально высокая температура кипения.
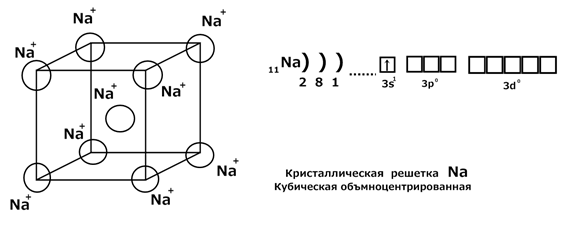
III Металлическая связь Металлическая связь – это связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке. Рассмотрим природу металлической связи на примере металлического Na. В узлах кристаллической решетки находятся ионы металла Na +, а электроны свободно омывают кристаллическую решетку, образуя «электронный газ». Такой вид связи характерен для металлов в твердом и жидком состояниях, в парах между атомами металла обычная ковалентная связь.
Таким типом связи объясняются электропроводность, теплопроводность и пластичность металлов. Поведение электронов металла описывает физика твердого тела Комплексные соединения Все химические соединения можно разделить на 2 большие группы: 1. Соединения 1-го рода. Атомы соединены за счет химических связей (H2O, CuSO4, …)
2. Соединения 2-го рода (высшего порядка, комплексные соединения). Они образуются из соединений первого рода за счет донорно-акцепторной связи. Комплексные соединения это соединения, которые невозможно описать с позиций обычной валентности или степеней окисления. Их очень много и они разнообразны хотя бы по цвету: Co2+ + 6CH3COO- «[Co(CH3COO)6]4- розовый Co2+ + 6NO2- «[Co(NO2)6]4- оранжевый Co2+ + 4Cl- «[CоCl4]2- синий Сo2+ + 4SCN- «[Co(SCN)4]2- фиолетовый Эти соединения могут содержать не только ионы, но и молекулы: Cu2+ + 4NH3 «[Cu(NH3)4]2+ синий Ni2+ + 6NH3 «[Ni(NH3)6]2+ фиолетовый В чем причина существования таких необычных соединений, за счет чего осуществляется химическая связь в них? Впервые теорию комплексных соединений предложил швейцарский химик Вернер в 1893г. Основные понятия координационной теории 1) В каждом комплексном соединении есть центральный ион комплексообразователь (К), обычно это положительно заряженный ион Ме. Ag+, Au3+, Cu2+, Fe2+, Fe3+, Hg2+, Pt2+, Pt4+… Центральный ион - это главным образом d-элементы, имеющие незаполненную d-оболочку, способную принимать электронные пары лигандов; тяжелые р-элементы, и элементы III группы, имеющие незаполненную р - оболочку. 2) Вокруг комплексообразователя координируется лиганды, т.е. ионы противоположного знака или нейтральные молекулы. Анионы: OH-, CN-, Cl-, CNS- Br -, NO2-, NO3-… Молекулы: H2O, NH3, CO… Катионы - NH2-NH3+, органические вещества. Все они должны иметь хотя бы одну неподеленную электронную пару. Лиганды бывают монодентатные – одна неподеленная пара, присоединяющаяся к центральному атому, и полидентатные - две или более групп в молекуле, которые могут быть донорами неподеленной пары. Полидентатные лиганды могут присоединяться к одному или разным атомам:
В последнем случае лиганды называются хелатными (клешневидными). Такие лиганды приводят к упрочнению комплекса - хелатный эффект. Наиболее важные для биолога хелатные комплексы: этилендиаминтетраацетатдинатрия (ЭДТА или Трилон Б). Имеет шесть донорных групп и связывает практически все металлы, начиная с Mg в соотношении 1:1. Гемоглобин - четыре атома азота вокруг атома железа(II), связанных в гем, пятая позиция занята белковой молекулой - глобином, и шестая - вода, которая и замещается на молекулу кислорода. Комплексный катион [Cu(NH3)4]SO4 · Сначала называют анион в именительном падеже: · Затем называют катион и в первую очередь называют лиганды с указанием их числа, при это используются греческие числительные (2-ди, 3-три, 4-тетра, 6-гекса и т.д.); · И в последнюю очередь катион в родительном падеже: Сульфат тетрааммин меди (II) [Ag(NH3)2]Cl – Хлорид диамин серебра (I)
Комплексный анион · Сначала называют лиганды, с указанием их числа; · Затем комплексообразователь; · Затем катионы – латинское название металла с указанием валентности; · Затем называют катион внешней сферы.
K3[Fe(CN)6] – Гексацианоферрат (III) калия K2[Fe(CN)6] – Гексацианоферрат (II) калия Na[Al(OH)4] – Тетрагидроксоалюминат натрия
Название лигандов: F – фторо ОН – гидроксо СN - циано Cl – хлоро Н2О – аква NO2 - нитро B – бромо NH3 – аммин SCN - тиоционато I – иодо CO – карбонил Порядок названия лигандов: сначала называются анионы, потом нейтральные молекулы, и наконец, катионы. Внутри каждой группы в порядке увеличения сложности. [Pt(NH3)4(NO2)Cl]SO4 - сульфат хлоронитротетрамминплатины(IV) NH4[Cr(NH3)2(NCS)4] - тетраизотиоцианатодиамминхромат(III) аммония. Если в названии лиганда присутствует уже ди- или три-, (этилендиамин), для благозвучия договорились количество лигандов обозначать бис-, трис-, тетракис-. K3[Al(C2O4)3] - триоксалатоалюминат(III) калия, но [Co(en)2Cl2]2SO4 - сульфат дихлоро-бис-этилендиаминкобальта(III) I. Метод валентных связей Попытка описать строение комплексов с позиций теории валентных связей (донорно-акцепторные связи) не дает хорошего результата. 1) Непонятно, почему комплексы окрашены, да еще по разному. 2) Количество связей. Ni(II) - 3d8. Даже если все электроны спарить, остается только одна орбиталь 3d, одна 4s и три 4р. Всего пять свободных орбиталей, а никель обычно образует шестикоординированные комплексы. 3) Откуда берутся магнитные свойства комплексных соединений? Магнитное поле в веществе отличается от магнитного поля в вакууме. Если в веществе есть свои элементарные магнитики (неспаренные электроны), поле в веществе усиливается, магнитики ориентируются в направлении поля. Это парамагнетизм. Если в веществе все электронные оболочки заняты электронами (все электроны спаренные), они ориентируются против поля, ослабляя его - диамагнетизм. Коэффициент, показывающий, насколько поле в веществе отличается от поля в вакууме - магнитная восприимчивость вещества c. Она связана с т.н. эффективным магнитным моментом mэф уравнением Возвращаясь к комплексным соединениям, можно опметить,что при одинаковом количестве d-электронов, например d6, [CoF5]3- парамагнитен, а [Co(NH3)6 - диамагнитен, [FeF6]4- парамагнитен, а [Fe(CN)6] диамагнитен. Теория валентных связей никак не разрешает это противоречие. Классификация ОВР ОВР делятся на 3 группы: 1. Внутримолекулярные реакции (окислитель и восстановитель в составе одного вещества.) 2. Межмолекулярные реакции (окислитель и восстановитель в составе разных веществ) 3. Реакции диспропорцио
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 68; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.175.180 (0.26 с.) |


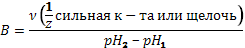
 исходное значение,
исходное значение,  значение после добавления щелочи или кислоты.
значение после добавления щелочи или кислоты. или
или  . Разбавление буферного раствора не влияет на его pH, но сильно сказывается на его буферной ёмкости, она уменьшается.
. Разбавление буферного раствора не влияет на его pH, но сильно сказывается на его буферной ёмкости, она уменьшается. Катионы - акцепторы электронных пар атома кислорода:
Катионы - акцепторы электронных пар атома кислорода:
 Н Z+
Н Z+ Н
Н

 Anz-.... H Z-
Anz-.... H Z-  О
О

 Н Z+
Н Z+



 Н Z-
Н Z-
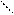 Anz-... O <=> HAn(z-l)-+ ОН-
Anz-... O <=> HAn(z-l)-+ ОН-





 , где b - магнетон Бора.
, где b - магнетон Бора.


