Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изменение свойств в периодах и в группах
Рассмотрим характер изменения некоторых свойств элементов с изменением заряда ядра их атомов. 1) Атомные радиусы в периоде с увеличением зарядов ядра в основном уменьшаются в связи с увеличением сил кулоновского притяжения. Радиусы одинаково заряженных ионов изменяются по такому же закону. В подгруппе с увеличением заряда ядра атомные и ионные радиусы, как правило, увеличиваются, что связанно с увеличением числа электронных уровней. 2) Энергия ионизации (I) (потенциал ионизации) в периоде возрастает с ростом заряда ядра (хотя и не монотонно т.к. зависит от энергетического состояния электрона), в главных и третьей побочной подгруппах – убывает сверху вниз в связи с появлением нового энергетического уровня. В остальных побочных подгруппах энергия ионизации возрастает с ростом заряда ядра. 3) Сродством к электрону (Е) – называют энергию, которая выделяется при присоединении дополнительного электрона к атому, иону или молекуле. Максимальным сродством к электрону обладают атомы галогенов. Сродство к электрону зависит не только от заряда атома, но и степени заполнения атомных орбиталей валентных уровней. 4) Электроотрицательность (ЭО) –это способность атомов одного элемента оттягивать на себя электроны от атомов другого элемента. Электроотрицательность в периоде возрастает и уменьшается в подгруппе с ростом заряда ядра. 5) Окислительная способность элемента меняется так же как и электроотрицательность, а восстановительная – наоборот. 6) Плотность простых веществ в периоде обычно проходит через максимум, лежащий примерно посередине периода и закономерно возрастает в подгруппе с ростом заряда ядра. 7) Основные свойства высших оксидов и гидроксидов элементов в периоде закономерно ослабляются, что связано с увеличением силы притяжения гидроксид-ионов к центральному атому с ростом заряда его ядра и уменьшением атомного радиуса, а в подгруппе, в основном, усиливаются, потому что атомный радиус элементов возрастает. 8) Кислотные свойства этих соединений изменяются в обратном направлении. Неметаллические свойства в периоде, как правило усиливаются слева направо, а в подгруппе – ослабевают сверху вниз, металлические – наоборот. Граница между металлами и неметаллами в таблице проходит по диагонали B-At таким образом, что все неметаллы находятся в верхней правой части таблицы (исключение составляют d- элементы).
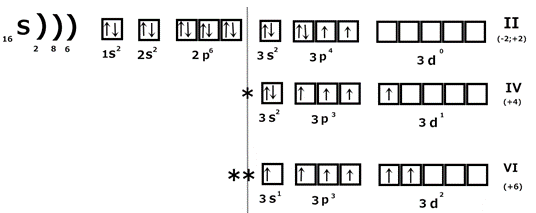
График, иллюстрирующий периодическое изменения энергии ионизации. Спиновая теория валентности Понятие валентности было введено в 1853г английским ученым Франкландом. Валентность элемента – это число химических связей, которые атом данного элемента образует с другими атомами в данной молекуле. Согласно современным представлениям валентность элемента определяется тремя факторами: 1) числом неспаренных электронов; 2) наличием свободных орбиталей и возможностью распаривания электронов; 3) наличием неподеленных электронных пар на внешнем уровне и возможностью донорно-акцепторного взаимодействия. Рассмотрим на примере серы:
Сера в основном состоянии имеет валентность II, в возбужденном IV и VI. Виды химической связи Учение о химической связи – центральный вопрос современной химии. Без него нельзя понять причину многообразия химических соединений, механизма их образования, строения и реакционной способности. Показатель, какая связь образуется между атомами – электроотрицательность элементов (ЭО).
Виды связи: I. Ионная – образуется при взаимодействии атомов которые сильно отличаются по электроотрицательности. Типичная ионная связь, это связь между металлами 1-й и 2-й группы и галогенами и кислородом. Связь осуществляется за счет электростатического притяжения. Li 0 – e = Li + (электронная конфигурация инертного газа He) F 0 + e = F - (электронная конфигурация инертного газа Ne) Ионы Li + и F - притягиваются за счет сил электростатического притяжения. Соединения с ионной связью обладают высокими температурами плавления. II. Ковалентная связь
|
|||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 76; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.1.158 (0.006 с.) |