
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Количественные характеристики процесса гидролиза
1. Степень гидролиза h (%, доли единицы). 2. Константа гидролиза (Кг). Обратимые реакции гидролиза, как и прочие обратимые процессы, подчиняются закону действующих масс, следовательно, для любого обратимого случая (типа) гидролиза можно записать выражение константы равновесия. Так, для реакции гидролиза NH4C1 + Н2О <=> NH4OH + HC1 или NH4+ + Н2О <=> NH4OH + Н+ Кравн= Тогда К г= Расчет констант гидролиза проводится по уравнениям, представленным в табл.1. Степень гидролиза h г - это отношение концентрации соли, подвергшейся гидролизу Ссоли, к общей концентрации соли Собщ.: h г = Связь количественных характеристик процесса гидролиза Kг и hг, а также расчет рН растворов солей, подвергающихся гидролизу представлены в табл.1.
Таблица 1. Уравнения для расчета Kг; hг и рН растворов солей, подвергающихся гидролизу
Тип Константа Степень гидролиза гидролиза гидролиза hг рН растворов
По аниону По катиону По катиону и аниону
Кw – ионное произведение воды = 10-14 (при 22 ◦С); Ка – константа диссоциации кислоты; С – молярная концентрация соли; рКа – силовой показатель кислоты; Кв – константа диссоциации основания; рКв – силовой показатель основания. Факторы, влияющие на гидролиз: Гидролиз – обратимый процесс, равновесие которого можно сместить под действием некоторых факторов. 1. Разбавление – усиливает гидролиз, hг увеличивается. 2. Нагревание – усиливает гидролиз, так как гидролиз эндотермический процесс (Q<0). 3. Удаление продукта гидролиза – усиливает гидролиз, смещает равновесие вправо. 4. Добавление одного из продуктов гидролиза – подавляет гидролиз, равновесие смещается влево. 5. Чем слабее кислота или основание (чем меньше их константа диссоциации), тем сильнее протекает гидролиз. 6. Гидролиз солей, образованных слабой кислотой и слабым основанием протекает сильнее всего и не зависит от концентрации.
Пример расчета константы гидролиза солей многоосновных кислот: Na 2 CO 3 1) CO32- + HOH <=> HCO3- + OH- 2) HCO3- +HOH <=> H2CO3 + OH- Кд (НСО3-) = 5,6 ∙ 10-11; Кг = Кд (Н2СО3) = 3,5 ∙ 10-7; Кг = 10-14/3.5 ∙ 10-7= 3∙ 10-6 Сравнение констант гидролиза 1 и 2 ступени показывает, что гидролиз почти полностью протекает по первой ступени. Значение гидролиза Гидролиз в широком смысле – это реакция обменного характера между различными веществами и водой. Он широко распространен в природе: 1. Гидролиз белков, жиров, углеводов. 2. Гидролиз неорганических веществ – карбидов, галогенидов. 3. рН плазмы крови поддерживается постоянным за счет реакций гидролиза: HCO3- +HOH <=> H2CO3 + OH- HP О 4 2- + H2O<=> H2P О 4 - + OH- 4. В больших масштабах применяется гидролиз солей Na3PO4 и Na2CO3 для очистки воды и уменьшения её жесткости. 5. В результате гидролиза минералов происходит разрушение горных парод. 6. В промышленности осуществляется гидролиз древесины, хлопковой шелухи, подсолнечной лузги, соломы, в результате чего из не пищевых продуктов получают этанол, белковые дрожжи, глюкозу и т.д. 7. Гидролиз солей, содержащихся в почве, сильно влияет на ее кислотность. Целый ряд удобрений относится к солям, гидролиз их также сказывается на кислотности почвы.
|
|||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 61; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.80.187 (0.006 с.) |
 , т.к. [Н2О] = const, то Кравн. • [Н2О] = Кг
, т.к. [Н2О] = const, то Кравн. • [Н2О] = Кг 
 %
%


 7+ '/2 рKа.+ '/2 lgCсоли
7+ '/2 рKа.+ '/2 lgCсоли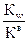
 7 - '/2 рKв - '/2 lgCсоли
7 - '/2 рKв - '/2 lgCсоли
 7+'/2 рKа.- '/2 р Кв.
7+'/2 рKа.- '/2 р Кв.



