Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства кислорода
“Кислород - это та ось, вокруг которой вращается химия” - Берцеллиус Кислород – самый распространенный элемент литосферы -75%(в виде силикатов и алюмосиликатов), в гидросфере -86%, в атмосфере 21% по объему. 1200 минералов содержат кислород. Аллотропия кислорода: Кислород существует в виде двух аллотропных модификаций: кислород и озон. Кислород -газ, без цвета, без запаха, t кип.=-183◦С, t пл.=-219◦С,в сжиженном состоянии – бледно-голубая жидкость, в 100 л H2O растворяется 3.1 объема O2.Специфическая особенность молекулы O2 –парамагнетизм, обусловленный наличием двух неспаренных электронов, O2- втягивается в магнитное поле. Кислород – сильный окислитель. Озон – газ, голубой, резкий запах, t кип.=-112◦С, t пл.=-193◦С, в сжиженном состоянии – бледно-голубая жидкость, в твердом - темно-фиолетовые кристаллы, в воде растворим лучше, чем кислород. Озон – более сильный окислитель, чем кислород. Получение: О2 в чистом виде существует в природе. Озон образуется при низких температурах, при разряде молнии. 3О2 = 2О3 - Q В лаборатории кислород получают по реакции: 2KMnO4→ K2MnO4 + MnO2+ О2 Соединения кислорода 1) Перекись водорода. Степень окисления -1. Может быть и окислителем и восстановителем. O2 + 2H++ 2e ® 2H2O2 Eo= 0.682В H2O2 + 2H+ + 2e ® 2H2O Eo=1.776В - очень сильный окислитель. В воде нестабильна, диспропорционирует. 2) Сжигая щелочные металлы в кислороде, получаем перекиси металлов. Ион О22- диамагнитен. O2+2Na →Na2O2 3) Сжигая тяжелые щелочные металлы (начиная с К) под давлением кислорода, получаем надперекиси КО2. Ион О2- парамагнитен, 1 неспаренный электрон. O2+K →KO2 4) Озон образует озониды: 3KOHтв + 2O3 ® 2KO3(тв)+KOH×H2O + 1/2O2. Соединения непрочные, сильнейшие окислители. 5) Кислород обратимо присоединяется к оксигенильным комплексам - гемоглобину, гемоцианину. Поиски искусственной крови. Остальные элементы VI группы Сера. В земной коре 0.1%. Встречается в виде: 1) самородная сера в виде молекул S8; 2) сульфидные руды: FeS2 – пирит, PbS, ZnS, HgS, FeS, CuS и другие сульфиды. Селен и теллур встречаются в виде селенидов и теллуридов металлов. 3) Сульфатные руды: CaSO4∙2H2O – гипс, Na2SO4∙10H2O – глауберова соль, MgSO4∙7H2O-горькая соль. 4) H2S – сероводородные источники. 5) Сера входит в состав белков. Для элементов VI группы характерна тенденция к образованию цепей - образование двойной связи как у кислорода становится все менее выгодно с увеличением размеров атомов, а наличие двух неспаренных р-электронов благоприятствует образованию длинных зигзагообразных цепей. Отсюда S8 -
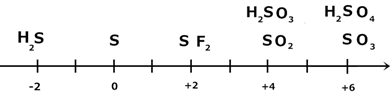
При нагревании выше 160 oC циклы разрываются и образуется пластическая сера, представляющая собой полимерную структуру. Таким образом, сера существует в виде трех аллотропных модификаций: ромбическая, моноклинная и пластическая сера. t пл.=119.3◦С; t кип.=445◦С. В парах при 900◦С сера существует в виде S2, только выше 1500 ◦С - S. Химические свойства серы Химические свойства серы и ее соединений можно легко объяснить, пользуясь ее шкалой степеней окисления:
1) S в окислительно-восстановительных реакциях может быть как окислителем, так и восстановителем. 2) H2S –только восстановитель; 3) SO3, H2SO4 – только окислители; в разбавленном (1 М) растворе H2SO4 очень плохой окислитель. 4) SO2, H2SO3 – могут быть как окислителями, так и восстановителями. Обычно H2SO3 и ее соли используются как хороший, мягкий восстановитель Изменение окислительно-восстановительных свойств соединений вниз по группе: 1) Растет восстановительная активность Н2Э. 2) Падает окислительная активность Э. 3) SeO 4 2- самый сильный окислитель; - вторичная периодичность. Водородные соединения
Стабильность падает по группе, межатомные взаимодействия растут (как и в VII группе). Исключение - вода. Опять неординарные свойства первого элемента группы - водородные связи между молекулами воды стабилизируют воду в целом и приводят к тому, что она жидкая при стандартных условиях. H 2 S – газ, бесцветный, запах тухлых яиц, токсичен, t кип.= -60◦С, t пл.= -86◦С, неустойчивое соединение. H2S - яд. Противоядие - окислители.
Получение H 2 S: Обычно получают, как и остальные халькогеноводороды по реакции: FeЭ + H2SO4 ® FeSO4 + Н2Э Н2Э - кислоты, но в отличие от VII группы, слабые. Сила кислот растет по группе. Восстановители. H2Se и H2Te восстанавливают воду. Взаимодействие с кислородом: 1) при избытке кислорода: 2H2S + 3O2® 2SO2 + 2H2O 2) при недостатке кислорода: 2H2S + O2® 2S + 2H2O Высокой прочностью связи S - S объясняется существование полисульфидов водорода (сульфанов): H2S2, H2S3, H2S4, которые имеют цепочечное строение: H-S-S-S-S-H. Сульфаны – желтые, вязкие маслообразные жидкости с резким запахом. Это более сильные кислоты, чем H2S (KI= 10-4). Полисульфиды: Na2S + (n-1)S →Na2Sn Полисульфиды Na, K, Ca, Ba, NH4+ пестициды с широким диапазоном действия. Сульфиды металлов H2S, слабая кислота: KI= 10-7, K2=10-14. Растворимы только сульфиды щелочных металлов. Осаждение сульфидов - способ разделения металлов в аналитической химии. Сульфиды выпадают в осадок при разных рН, в зависимости от их произведения растворимости. Ag2S ПР=2.0×10-50; CdS ПР=1.6×10-28; Bi2S3 ПР=1.0×10-97 СuS ПР=6.3×10-36; HgS ПР=1.6×10-52; PbS ПР=2.5×10-27. Эти сульфиды осаждаются в кислой среде. СoS ПР=4×10-21; FeS ПР=5×10-18; MnS ПР=2.5×10-10; NiS ПР=3.2×10-19 Эти сульфиды осаждаются в щелочной среде (Na2S).
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 51; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.128.129 (0.013 с.) |