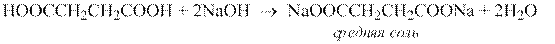Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окисление первичных спиртов.
Первичные спирты окисляются до карбоновых кислот перманганатом калия в кислой или щелочной среде, либо другим окислителем.
Окисление альдегидов. Для окисления альдегидов используют перманганат калия, дихромат калия, а также оксид серебра.
Окисление алкилбензолов. В качестве окислителей используют перманганат калия, соединения хрома(VI), азотную кислоту и т.д. Толуол → Бензойная кислота.
Гидролиз нитрилов. Нитрилы подвергаются гидролизу как в кислой, так и в щелочной среде, например:
Гидролиз функциональных производных карбоновых кислот (ацилгалогенидов, ангидридов, сложных эфиров, амидов и т.д.). Все функциональные производные карбоновых кислот при гидролизе в кислой или щелочной среде образуют карбоновые кислоты или их соли.
Гидролиз тригалогенопроизводных. Тригалогенопроизводные гидролизуются в соответствующие карбоновые кислоты.
Вопросы для самостоятельного решения: 8. Одним из промышленных способов получения карбоновых кислот является каталитическое окисление алканов кислородом воздуха. При этом углеродная цепь исходного углеводорода разрывается посередине. Напишите уравнение реакции получения уксусной кислоты окислением н-бутана. Какую формулу имеет алкан, окислением которого получают стеариновую кислоту? 9. Какое вещество образуется при гидролизе бутаннитрила? Напишите уравнение реакции. 10. Какие продукты образуются при окислении н-пропилбензола? Напишите уравнение реакции. 11. Приведите не менее трех уравнений реакций, в результате которых может быть получена уксусная кислота. Укажите условия реакций. 12. При окислении каких первичных спиртов можно получить следующие кислоты: а) 2.3- диметилбутановую, б)изовалериановую? Напишите схемы уравнений реакций. 13. Напишите схему превращений, с помощью которой из 1.2-дихлорэтана можно получить янтарную (бутандиовую) кислоту. Укажите условия реакций.
Химические свойства.
Карбоновые кислоты содержат функциональную группу СООН, связанную с радикалом или атомом водорода.
В молекулах карбоновых кислот можно выделить ряд реакционных центров:
· ОН-кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями; · электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения; · основный центр – оксогруппа со своей неподеленной парой электронов, которая протонируется на стадии катализа в реакциях нуклеофильного замещения; · СН-кислотный центр, возникающий у α-атома углерода за счет индуктивного эффекта карбоксильной группы. Кислотный характер карбоновых кислот ярко выражен. Это объясняется взаимным влиянием атомов в карбоксильной группе: в ней электронная плотность смещена в сторону наиболее электроноакцепторного атома кислорода карбонильной группы. Это приводит к ослаблению связи между кислородом и водородом в гидроксильной группе и легкости отщепления атома водорода от гидроксила в виде протона (Н+). Появление пониженной электронной плотности (δ+) на углеродном атоме карбоксила приводит также к стягиванию σ-электронов соседней связи С-С к карбоксильной группе и появлению пониженной электронной плотности δ'+ на α-углеродном атоме кислоты.
Кислотные свойства В водных растворах они слабо диссоциированы, кислая среда обнаруживается с помощью индикаторов. При взаимодействии с основаниями, карбонатами, гидрокарбонатами и аммиаком карбоновые кислоты образуют соли:
Дикарбоновые кислоты содержат две карбоксильные группы, поэтому они образуют два ряда солей – кислые и средние.
Более сильные кислотные свойства карбоновых кислот по сравнению с другими ОН-кислотами Бренстеда (спиртами и большинством фенолов) объясняется тем, что атомы кислорода и углерод в карбоксильной группе стабилизированы за счет сопряжения. В анионе происходит полная делокализация π-электронной плотности, вследствие чего отрицательный заряд поровну распределяется между двумя атомами кислорода:
Строение радикала влияет на кислотные свойства карбоновых кислот. Электронодонорные заместители снижают кислотность. Ненасыщенные и ароматические кислоты обладают большей кислотностью, чем насыщенные алифатические. Ароматические кислоты с заместителем в орто -положении более сильные, чем мета - и пара -изомеры. Электроноакцепторные заместители усиливают кислотность. Замещенные карбоновые кислоты различаются по своей силе. Все моно-, ди- и тригалогензамещенные производные уксусной кислоты превосходят уксусную кислоту по величине константы диссоциации. Константа диссоциации трифторуксусной кислоты ~ в 50000 раз больше константы диссоциации уксусной кислоты. Изменение кислотности карбоновых кислот основывается на индуктивном эффекте заместителей. Заместители, обладающие отрицательным индуктивным эффектом (- I эф), стабилизируют карбоксилат-анион, что непосредственно отражается на значении р Ка соответствующих кислот. Вследствие затухания индуктивного эффекта второй карбоксильной группы кислотные свойства дикарбоновых кислот (по первой ступени диссоциации) уменьшаются по мере удаления карбоксильных групп друг от друга.
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 131; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.230.82 (0.009 с.) |