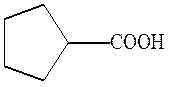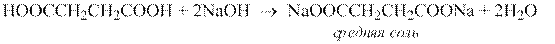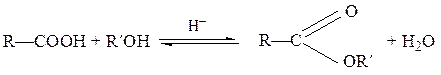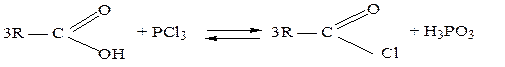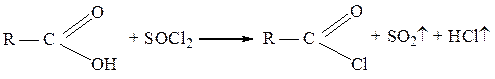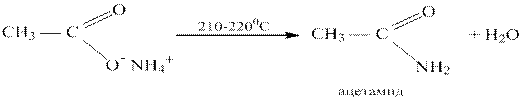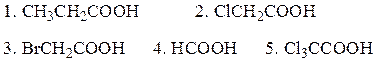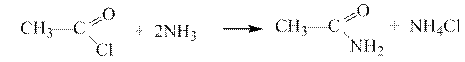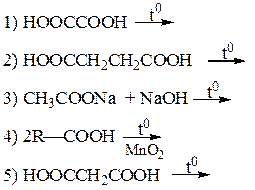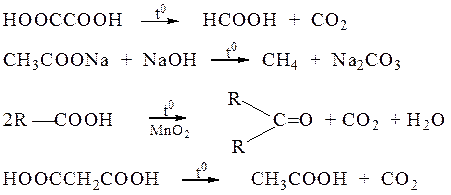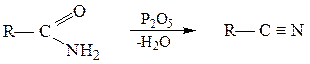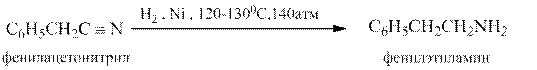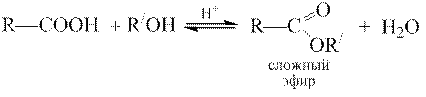Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Функциональные производные карбоновых кислот»Стр 1 из 14Следующая ⇒
Функциональные производные карбоновых кислот»
Екатеринбург, 2018 Учебное пособие «Карбоновые кислоты. Функциональные производные карбоновых кислот» по органической химии / Т.Н. Ведерникова – Екатеринбург; Фармацевтический филиал ГБПОУ «СОМК», 2018. 75с
Рецензент: А.И. Серебрякова – кандидат химических наук, преподаватель химии высшей квалификационной категории медицинского колледжа УрГУПС.
Учебное пособие посвящено соединениям, объединенным под общим названием «Карбоновые кислоты. Функциональные производные карбоновых кислот». В пособии изложен теоретический материал, разобран ряд эталонных задач, а также приведены вопросы и задачи для самостоятельной работы студентов. Пособие рекомендуется использовать студентам очной и очно-заочной формы обучения для подготовки к занятиям по органической химии. Рассмотрено и одобрено на заседании ЦМК химии протокол № 5 от «07» декабря 2018г.
Рассмотрено и одобрено на заседании Центрального методического совета колледжа от «__» ___________2019 г.
Председатель ЦМС ___________ О.В. Ледянкина, к. фарм.наук.
Оглавление Пояснительная записка. 5 I.Карбоновые кислоты.. 6 1.1. Нахождение в природе и значение для фармации. 6 2. Изомерия и номенклатура. 7 3. Физические свойства. 11 4. Способы получения. 12 4.1. Окисление первичных спиртов. 12 4.2. Окисление альдегидов. 12 4.3. Окисление алкилбензолов. 12 4.4. Гидролиз нитрилов. 13 4.5. Гидролиз функциональных производных карбоновых кислот (ацилгалогенидов, ангидридов, сложных эфиров, амидов и т.д.). 13 4.6. Гидролиз тригалогенопроизводных. 13 5. Химические свойства. 14 5.1. Кислотные свойства. 15 6. Отдельные представители карбоновых кислот. 22 II.Функциональные производные карбоновых кислот. 26 2.1. Номенклатура. 26 2.2. Химические свойства производных карбоновых кислот. 27 3. Галогенангидриды. 28 2.4. Ангидриды.. 29 2.5. Сложные эфиры. 31 2.6. Амиды. 32 2.7. Нитрилы. 35 8. Вопросы с эталоном решения. 36 9. Вопросы для самостоятельного решения. 37 III.Гидроксикислоты. 38 1. Общая характеристика. 38 1.1. Некоторые биогенные гидроксикарбоновые кислоты.. 39 2. Способы получения. 42 2.1. Гидролиз галогенозамещённых карбоновых кислот. 42
2.2. Омыление гидроксинитрилов. 42 2.3. Гидратация непредельных карбоновых кислот. 42 2.4. Окисление гидроксиальдегидов и гликолей. 43 3. Физические и химические свойства. 43 3.1. Восстановление α-гидроксикислот. 44 3.2. Нагревание α-гидроксикислот. 44 3.3. Реакция дегидратации α-, β- и γ-гидроксикислот. 44 4. Отдельные представители. 46 6. Вопросы для самостоятельного решения. 49 IV.Фенолокислоты.. 50 1. Общая характеристика. 50 2. Способы получения. 50 3.Химические свойства. 51 3.2. Реакции по фенольной группе (–ОН группе). 53 3.3. Реакции по бензольному кольцу. 54 3.4. Качественные реакции. 54 4. Применение салициловой кислоты в фармации. 54 5.Вопросы с эталоном решения. 55 6.Вопросы для самостоятельного решения. 56 V.Аминокислоты.. 56 1.Общая характеристика. 56 1.1 Классификация аминокислот. 57 1.2. Стереоизомерия аминокислот. 59 2.Физические свойства аминокислот. 60 3.Химические свойства аминокислот. 61 3.1.Амфотерность аминокислот. 61 3.2.Реакции карбоксильной группы.. 62 3.3.Реакции аминогруппы.. 65 3.4.Специфические реакции α-аминокислот. 68 3.5.Специфические реакции β- аминокислот. 70 3.6.Специфические реакции γ-аминокислот. 70 4. Качественные реакции на аминокислоты. 71 4.1 Нингидриновая реакция(Реакция Руэманна) 71 4.2. Реакция Фоля. 71 4.3. Образование комплексов с металлами. 72 4.4. Ксантопротеиновая реакция. 72 5. Вопросы с эталоном решения. 73 6. Вопросы для самостоятельного решения. 74 Литература. 75
Пояснительная записка Органическая химия – большой самостоятельный раздел химии, предметом которого является химия углеводородов и их функциональных производных; их строение, свойства, методы получения, возможности практического использования. Органическая химия играет большую роль в медицине, фармации. Главной задачей настоящего пособия является содействие более глубокому усвоению материала по органической химии: раздела «Гомофункциональные и гетерофункциональные соединения», на изучение которого согласно рабочей программе ОП.09 Органическая химия по специальности 33.02.01 Фармация запланирован 101 час. В пособии особое внимание уделяется центральной роли, которую играют карбоновые кислоты и их производные в жизни и фармацевтической практике. Знания реакционной способности органических веществ необходимы для выполнения задач профессиональной деятельности фармацевта. Данное учебное пособие включает теоретическую часть материала о гомофункциональных и гетерофункциональных соединениях. Акцентируется внимание на номенклатуру функциональных производных карбоновых кислот.
В конце каждого раздела приводятся контрольные вопросы и эталоны ответов к ним. Предлагаются вопросы для самостоятельной работы, выполнение которых поможет студентам более детально изучить материал.
Уважаемые студенты, желаем вам успешного освоения этой интересной науки – ОРГАНИЧЕСКАЯ ХИМИЯ.
I.Карбоновые кислоты Изомерия и номенклатура. К классу карбоновых кислот относятся соединения, содержащие карбоксильную группу COOH. По числу карбоксильных групп в молекуле различают одноосновные R-COOH и многоосновные кислоты HOOC-CH2 -COOH В зависимости от строения углеводородного радикала, связанного с карбоксильной группой, кислоты подразделяются на алифатические (насыщенные и ненасыщенные), алициклические, ароматические, гетероциклические.
По заместительной номенклатуре алифатические монокарбоновые кислоты называют по соответствующим предельным углеводородам с добавлением окончания -овая кислота, нумерация цепи начинается от углерода карбоксильной группы. В тех случаях, когда карбоксильная группа не входит в состав углеводородной цепи, используется сочетание «карбоновая кислота», выполняющее роль суффикса.
циклопентанкарбоновая кислота
Номенклатура ИЮПАК разрешает использовать тривиальные названия, указывающие на природный источник, из которого была выделена кислота.
Для первого представителя ароматических кислот ИЮПАК сохранено название «бензойная кислота» (C6H5СОOH). Замещенные ароматические монокарбоновые кислоты называют, используя бензойную кислоту в качестве родоначальной структуры:
4-метилбензойная кислота 3-нитробензойная кислота
Применяют также систему, согласно которой за основу принимают тривиальное название кислоты, соответствующей самой длинной в молекуле цепи, а атомы обозначают, начиная с соседнего с карбоксильной группой, буквами греческого алфавита.
2-метилбутановая (α-метилмасляная) кислота Изомерия предельных одноосновных карбоновых кислот обусловлена разветвленностью углеродного скелета, взаимным расположением заместителей. Число изомеров увеличивается по мере возрастания углеродной цепи.
Вопросы с примерами решений. 1. Насыщенными дикарбоновыми кислотами являются: а. терефталевая, фумаровая, лимонная; б. винилуксусная, кротоновая, акриловая; в. малоновая, янтарная, глутаровая; г. изовалериановая, масляная, уксусная;
Решение -1: Насыщенные дикарбоновые кислоты содержат две карбоксильные группы, связанные с углеводородным радикалом, в котором все атомы углерода находятся в состоянии s p 3-гибридизации. Следовательно, это - малоновая (HOOCCH2COOH), янтарная (HOOCCH2CH2COOH), глутаровая (HOOCCH2CH2CH2COOH) кислоты. 2. Приведите систематические названия следующих карбоновых кислот: а. CH3CH2 CH(CH3)COOH б.(CH3)2CH CH2 CH2 COOH
в.CH3CH2 C(CH3)2 CH2COOH
Решение -2: а. Выбираем родоначальную структуру - это самая длинная углеводородная цепь, содержащая карбоксильную группу, нумеруем атомы углерода, начиная с углерода карбоксильной группы, всего четыре, у второго атома углерода- радикал метил. Корнем слова - бутан + окончание -овая кислота (указывает на наличие карбоксильной группы), префиксом слова - название радикала, цифра указывает его положение в цепи: 2-метилбутановая кислота (2-метилмасляная кислота) б. 4-метилпентановая кислота (4-метилвалериановая кислота) в. 3,3-диметилпентановая кислота (3,3-диметилвалериановая кислота)
3. Написать формулы возможных изомеров карбоновых кислот, отвечающих составу C5H10O2 Решение -3: Напишем структурную формулу кислоты, имеющий неразветвленный углеродный скелет: а.CH3-CH2-CH2-CH2-COOH Углеродную цепь сократим на один атом и пришьем его к любому (кроме первичного) атому углерода: б. CH3CH2 CH(CH3)COOH в. CH3 CH(CH3)CH2 COOH г. Сократим родоначальную структуру еще на один атом углерода, пришив два атома углерода к вторичному атому цепи: CH3 -C(CH3)2 -COOH
Вопросы для самостоятельного решения 4. Напишите формулы изомеров 2.3-диметилпентановой кислоты. 5. Среди перечисленных веществ выберите:1) изомеры 2) гомологи а) CH3-CH2-CH2- COOH в) HOOC- COOH б) HOOC- CH2-COOH г) CH3-CH(CH3 ) - COOH Назовите приведенные вещества.
Физические свойства. На физических свойствах карбоновых кислот сказывается значительная степень ассоциации молекул вследствие образования водородных связей. В газовой фазе и в неполярных растворителях монокарбоновые кислоты существуют в виде димеров.
Водородные связи, возникающие в карбоновых кислотах объясняют значительно высокие температуры кипения кислот. Монокарбоновые кислоты с числом атомов углерода от 1 до 3 – бесцветные жидкости, смешиваются с водой в любых соотношениях. Кислоты, в молекуле которых содержится от 4 до 9 атомов углерода – маслянистые жидкости, растворимость их в воде невелика. Растворимость в воде высших гомологов уменьшается по мере удлинения углеродного радикала. Практически все дикарбоновые и ароматические кислоты – твердые вещества. В ряду дикарбоновых кислот наблюдаются те же закономерности: низшие гомологи лучше растворяются в воде, чем высшие. Ароматические кислоты плохо растворимы в воде.
Вопросы для самостоятельного решения: 6. Между молекулами какого вещества имеются водородные связи: а) этаналь б) метан в) ацетон г)3-метилмасляная кислота. 7. Какая из приведенных ниже кислот имеет самую высокую температуру кипения: а) уксусная б) 3-метилмасляная в) масляная г) капроновая
Способы получения. Окисление альдегидов. Для окисления альдегидов используют перманганат калия, дихромат калия, а также оксид серебра.
Окисление алкилбензолов. В качестве окислителей используют перманганат калия, соединения хрома(VI), азотную кислоту и т.д. Толуол → Бензойная кислота.
Гидролиз нитрилов. Нитрилы подвергаются гидролизу как в кислой, так и в щелочной среде, например:
Химические свойства.
Карбоновые кислоты содержат функциональную группу СООН, связанную с радикалом или атомом водорода.
В молекулах карбоновых кислот можно выделить ряд реакционных центров:
· ОН-кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями; · электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения; · основный центр – оксогруппа со своей неподеленной парой электронов, которая протонируется на стадии катализа в реакциях нуклеофильного замещения; · СН-кислотный центр, возникающий у α-атома углерода за счет индуктивного эффекта карбоксильной группы. Кислотный характер карбоновых кислот ярко выражен. Это объясняется взаимным влиянием атомов в карбоксильной группе: в ней электронная плотность смещена в сторону наиболее электроноакцепторного атома кислорода карбонильной группы. Это приводит к ослаблению связи между кислородом и водородом в гидроксильной группе и легкости отщепления атома водорода от гидроксила в виде протона (Н+).
Появление пониженной электронной плотности (δ+) на углеродном атоме карбоксила приводит также к стягиванию σ-электронов соседней связи С-С к карбоксильной группе и появлению пониженной электронной плотности δ'+ на α-углеродном атоме кислоты.
Кислотные свойства В водных растворах они слабо диссоциированы, кислая среда обнаруживается с помощью индикаторов. При взаимодействии с основаниями, карбонатами, гидрокарбонатами и аммиаком карбоновые кислоты образуют соли:
Дикарбоновые кислоты содержат две карбоксильные группы, поэтому они образуют два ряда солей – кислые и средние.
Более сильные кислотные свойства карбоновых кислот по сравнению с другими ОН-кислотами Бренстеда (спиртами и большинством фенолов) объясняется тем, что атомы кислорода и углерод в карбоксильной группе стабилизированы за счет сопряжения. В анионе происходит полная делокализация π-электронной плотности, вследствие чего отрицательный заряд поровну распределяется между двумя атомами кислорода:
Строение радикала влияет на кислотные свойства карбоновых кислот. Электронодонорные заместители снижают кислотность. Ненасыщенные и ароматические кислоты обладают большей кислотностью, чем насыщенные алифатические. Ароматические кислоты с заместителем в орто -положении более сильные, чем мета - и пара -изомеры. Электроноакцепторные заместители усиливают кислотность. Замещенные карбоновые кислоты различаются по своей силе. Все моно-, ди- и тригалогензамещенные производные уксусной кислоты превосходят уксусную кислоту по величине константы диссоциации. Константа диссоциации трифторуксусной кислоты ~ в 50000 раз больше константы диссоциации уксусной кислоты. Изменение кислотности карбоновых кислот основывается на индуктивном эффекте заместителей. Заместители, обладающие отрицательным индуктивным эффектом (- I эф), стабилизируют карбоксилат-анион, что непосредственно отражается на значении р Ка соответствующих кислот. Вследствие затухания индуктивного эффекта второй карбоксильной группы кислотные свойства дикарбоновых кислот (по первой ступени диссоциации) уменьшаются по мере удаления карбоксильных групп друг от друга. Образование сложных эфиров При взаимодействии карбоновых кислот со спиртами в присутствии кислотных катализаторов образуются сложные эфиры, а сама реакция называется реакцией этерификации:
сложный эфир В качестве катализаторов используют концентрированную серную кислоту, газообразный хлороводород, сульфоновые кислоты. Для двухосновных карбоновых кислот возможно образование неполного и полного эфиров. Например, щавелевая кислота образует полный этиловый эфир: диэтилоксалат.
Реакция этерификации обратима. При получении сложных эфиров смещение равновесия вправо достигается разными способами: удалением воды азеотропной отгонкой или с помощью осушителей, ибо с применением большого избытка спирта или кислоты. Смещение равновесия достигается также путем отгонки образующегося сложного эфира.
Образование галогенангидридов. При взаимодействии карбоновых кислот с галогенидами фосфора(III) или фосфора (V), а также фосфорилхлоридом POCl3 образуются галогенангидриды, иначе называемые ацилгалогенидами:
Для получения хлорангидридов, часто используют также тионилхлорид SOCl2:
Образование ангидридов. Под действием такого сильного водоотнимающего средства, как оксид фосфора (V), карбоновые кислоты превращаются в ангидриды:
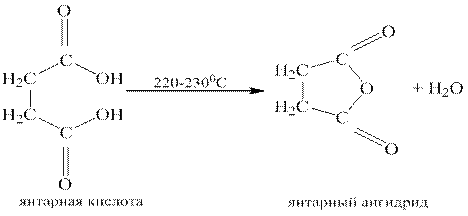
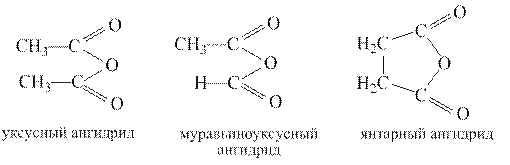
Ангидриды некоторых дикарбоновых кислот образуются при их нагревании и в отсутствие водоотнимающих средств. Важно, чтобы образующийся циклический ангидрид содержал пяти- или шестичленный цикл. Такие ангидриды образуют, например, янтарная, глутаровая и фталевая кислоты.
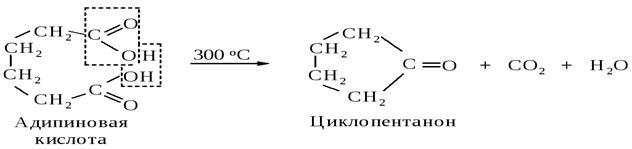
Длина цепи, разделяющей карбоксильные группы, определяет характер превращений дикарбоновых кислот при нагревании. Если придекарбоксилировании возможно образование устойчивых пяти-шести членных циклов, то они образуются. При нагревании адипиновой, пимелиновой (гептандиовой), пробковой (октандиовой) кислот происходит отщепление оксида углерода (IV) и воды, образуются циклические кетоны.
Образование амидов.
При нагревании аммониевых солей карбоновых кислот получаются амиды:
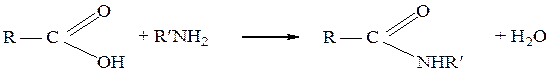
При взаимодействии карбоновых кислот с первичными или вторичными аминами образуются соответственно моно- и дизамещенные амиды:
Вопросы с эталоном решения: 14. Наиболее сильной кислотой является:
Решение-14: Строение радикала влияет на кислотные свойства карбоновых кислот. Электроноакцепторные заместители усиливают кислотность, а электронодонорные – снижают. Следовательно, наиболее сильной кислотой является трихлоруксусная (Cl3CCOOH).
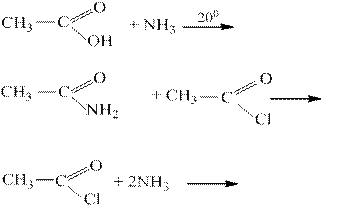
15. Этанамид образуется в результате реакции:
Решение-15: Методом получения амидов является ацилирование аммиака и аминов галогенангидридами, ангидридами и сложными эфирами.
16. Реакцией декарбоксилирования является:
Решение-16: В процессе декарбоксилирования карбоновые кислоты отщепляют оксид углерода (IV) и превращаются в соединения разных классов в зависимости от условий проведения реакции.
Ответ: 1; 3; 4; 5.
Вопросы для самостоятельного решения:
17. Приведите пример органического соединения, которое может реагировать и с магнием, и с гидроксидом натрия, и с этанолом, и аммиаком. Напишите уравнения реакций. 18. Напишите уравнения реакций, с помощью которых можно осуществить превращения: пропаннитрил → пропановая кислота → хлорангидрид пропановой кислоты → метилпропаноат
19. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Уксусная кислота → ангидрид уксусной кислоты → этилацетат → ацетат натрия
20. Напишите реакции, протекающие при нагревании щавелевой, этилмалоновой и метилянтарной кислот в присутствии серной кислоты.
21. Напишите схемы получения этилбутаноата различными способами. 22. СоединениеА(C11H12O2) может вступать в реакции, протекающие по механизмам электрофильного присоединения и электрофильного замещения, а также в реакции нуклеофильного замещения. При взаимодействии с гидроксидом натрия при нагревании вещество А превращается в соединение Б(C10H9O2 Na), в реакциях с бромом в тетрахлорметане – в соединение В (C11H12 Br2O2), а при кипячении с водным раствором перманганата калия- в соединение Г (C8H6O4). Предложите одну из возможных структур А и напишите уравнения соответствующих реакций.
Номенклатура. Номенклатура производных карбоновых кислот исходит из названий самих карбоновых кислот. Ангидриды кислот называют добавляя слово «ангидрид» к названию соответствующей кислоты.
Для обозначения галогенангидридов (ацилгалогенидов) RC(O)Hal окончание кислоты «- овая» заменяется на «- оил» с добавлением названия галогена.
Для обозначения амидов RC(O)NH2 окончание «-овая», характерное для кислот, заменяется на «- амид», или окончание «карбоновая кислота» заменяется на «карбоксамид».
Замещенные при азоте амиды имеют префикс, где обозначаются эти заместители.
Название сложных эфиров строится таким образом: первая часть названия -обозначение алкильной группы, присоединенной к атому кислорода. Вторая часть названия - обозначение карбоновой кислоты, в котором окончание «- овая» заменено на окончание «- ат».
Для нитрилов существует несколько систем названий. Согласно номенклатуре ИЮПАК они называются алканнитрилами, т.е. к названию алкана добавляется окончание «- нитрил». Атом углерода нитрильной группы всегда имеет первый номер.
Нитрилы также рассматривают как производные карбоновых кислот и именуют как производные соответствующих карбоновых кислот, например, CH3C≡N — ацетонитрил (нитрил уксусной кислоты), C6H5CN — бензонитрил (нитрил бензойной кислоты). В систематической (русской) номенклатуре для именования нитрилов используется суффикс «- карбонитрил», либо окончание «- овая» заменяется на «- онитрил»
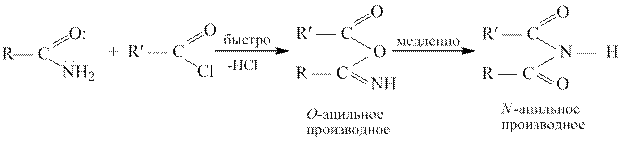
Реакции ацилирования.
Галогенангидриды относятся к наиболее активным ацилирующим агентам, их используют для получения большинства других функциональных производных карбоновых кислот [реакции (2) – (6)]. Ацилгалогениды очень легко гидролизуются в карбоновые кислоты [реакция(1)].С помощью галогенангидридов удается проацилировать такие соединения, которые не реагируют с другими ацилирующими агентами, например, третичные спирты и фенолы.
Ангидриды Ангидридами называются функциональные производные карбоновых кислот общей формулы RC(O)OC(O)R/ Ангидриды можно рассматривать как продукты отщепления воды от карбоксильных групп двух молекул монокарбоновой кислоты или одной молекулы дикарбоновой кислоты.
Ангидриды представляют собой жидкости или твердые вещества, низшие ангидриды имеют раздражающий запах, похожий на запах соответствующей кислоты. Реакции ацилирования. Реакции ацилирования протекают в условиях как кислотного, так и основного катализа или без катализатора Высокая ацилирующая способность ангидридов используется для получения большинства функциональных производных карбоновых кислот, как показано на примере уксусного ангидрида:
Сложные эфиры.
Сложными эфирами называются функциональные производные карбоновых кислот общей формулы RC (O) OR /. Сложные эфиры низших спиртов и карбоновых кислот представляют собой летучие жидкости с приятным запахом, плохо растворимые в воде и хорошо – в большинстве органических растворителей. Запахи сложных эфиров напоминают запахи разных фруктов и цветов. Например, запах жасмина - бензилпропаноат, хризантемы – сложный эфир фенилэтилового спирта и муравьиной кислоты. Сложные эфиры, которые имеют цветочные запахи, это чаще всего производные ароматических кислот или ароматических спиртов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Воски не растворяются в воде. Примерами животных восков могут служить пчелиный воск, а также ворвань (спермацет), содержащийся в черепной коробке кашалота (кашалотовый воск). Пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат): CH3(CH2)14–CO–O–(CH2)29CH3. Гидролиз. Важнейшей из реакций ацилирования является гидролиз сложных эфиров с образованием спирта и карбоновой кислоты:
Реакция осуществляется как в кислой, так и в щелочной среде. Смещение равновесия в сторону образования спирта и кислоты обеспечивается добавлением избытка воды. Щелочной гидролиз необратим, в процессе реакции на моль эфира расходуется моль щелочи, т.е. щелочь в этой реакции выступает в качестве расходуемого реагента, а не катализатора:
Восстановление.
Сложные эфиры чаще восстанавливают в первичные спирты, реже в альдегиды или простые эфиры. Обычно для восстановления используют алюмогидрид лития.
Аммонолиз. При нагревании эфиров карбоновых кислот с аммиаком и аминами образуются амиды:
Амиды.
Амидами называются функциональные производные карбоновых кислот общей формулы R ─ C (O)─ NH 2- n R ' n, где n =0-2. В незамещенных амидах ацильный остаток соединен с незамещенной аминогруппой, а в N -замещенных амидах один из атомов водорода замещен одним алкильным или арильным радикалом, в N, N -дизамещенных – атомы водорода аминогруппы замещены двумя радикалами. Амиды представляют собой кристаллические вещества с относительно высокими и четкими температурами плавления, что позволяет использовать некоторые из амидов в качестве производных для идентификации карбоновых кислот.
Кислотно-основные свойства.
Амиды обладают слабыми как кислотными, так и основными свойствами. Причиной пониженной основности аминогруппы в амидах является сопряжение неподеленной пары электронов атома азота с карбонильной группой. При взаимодействии с сильными кислотами амиды протонируются по атому кислорода как в разбавленных, так и в концентрированных растворах кислот.
Кислотно-основное взаимодействие лежит в основе образования амидами межмолекулярных ассоциатов, существованием которых объясняются высокие температуры плавления и кипения амидов. Возможно существование двух типов ассоциатов: линейных полимеров и циклических димеров.
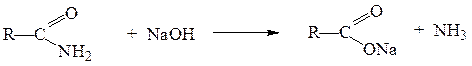
Реакции ацилирования. Из числа реакций ацилирования практическое значение имеет гидролиз амидов, который можно проводить в кислой и щелочной средах. Амиды гидролизуются намного труднее, чем другие функциональные производные карбоновых кислот. Гидролиз амидов проводится в более жестких условиях по сравнению с гидролизом сложных эфиров. Кислотный гидролиз амидов – необратимая реакция, приводящая к образованию карбоновой кислоты и аммониевой соли:
Щелочной гидролиз тоже необратимая реакция; в результате её образуется соль карбоновой кислоты и аммиак или амин:
Дегидратация.
Незамещенные амиды под действием оксида фосфора (V) и некоторых других реагентов (POCl3, PCl5, SOCl2) превращаются в нитрилы:
Восстановление. В зависимости от применяемого реагента амиды могут быть восстановлены в амины (без разрыва связей C─ N) или в альдегиды (с разрывом связи C─ N). При действии алюмогидрида лития амиды восстанавливаются в первичные, вторичные и третичные амины:
Ацилирование амидов.
При нагревании незамещенных или N -монозамещенных амидов с ангидридами или галогенангидридами образуются имиды, т.е. диацильные производные аммиака
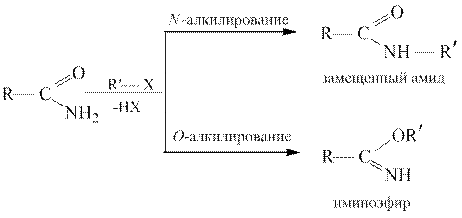
Алкилирование. Алкилирование амидов, как и ацилирование, можно осуществить по атомам азота и кислорода:
Продукты N -алкилирования термодинамически более устойчивы по сравнению с продуктами О -алкилирования, которые называются иминоэфирами или имидатами. Галогенирование.
Галогенирование амидов в избытке щелочи сопровождается расщеплением амидов (расщепление по Гофману) и приводит к образованию первичных аминов, имеющих в молекуле на один атом углерода меньше, чем в исходном амиде:
Нитрилы. Нитрилами (цианидами) называются соединения общей формулы R ─ C ≡ N Нитрилы отличаются по строению от ацильных производных, и к группе функциональных производных карбоновых кислот их относят потому, что они гидролизуются с образованием карбоновых кислот или амидов.
Гидролиз. Нитрилы относятся к очень слабым ацилирующим агентам, более слабым, чем даже амиды, поэтому они гидролизуются (в кислой или щелочной среде) значительно труднее ацильных производных:
Восстановление.
Нитрилы могут быть восстановлены в первичные амины разными методами – каталитическим гидрированием, натрием в этаноле, алюмогидридом лития, например:
По сравнению с другими функциональными производными карбоновых кислот нитрилы восстанавливаются значительно труднее.
Вопросы с эталоном решения. 27. Реакцией этерификации является:
Решение-27: При взаимодействии карбоновых кислот со спиртами в присутствии кислотных катализаторов образуются сложные эфиры, а реакция называется – этерификацией:
Ответ: 2.
Установите соответствие.
Решение-28:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 141; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.9.236 (0.286 с.) |