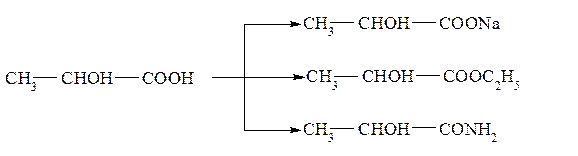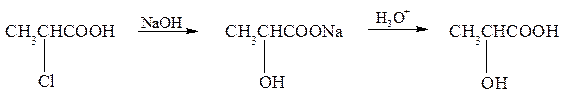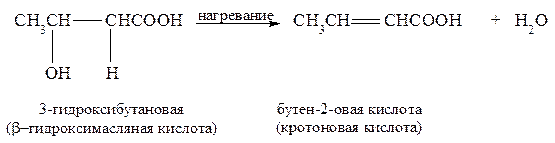Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физические и химические свойства
Гидроксикислоты – жидкости или большей частью кристаллические вещества. В воде они растворимы лучше, чем соответствующие карбоновые кислоты, не содержащие гидроксила. Низшие гидроксикислоты смешиваются с водой в любых соотношениях. Гидроксикислоты проявляют свойства кислот и спиртов. Как кислоты они дают соли, сложные эфиры, амиды и т.д.:
Как спирты гидроксикислоты образуют алкоголяты, простые эфиры, замещают гидроксил галогеном:
Вступление в реакцию спиртового или кислотного гидроксила определяется выбором реагента и условиями реакции. Так, при действии галогеноводородов замещается галогеном только спиртовой гидроксил, а при действии пентахлорид фосфора – и кислотный, и спиртовой. При действии щелочных металлов (натрий) сначала получаются соли кислот, а затем алкоголяты. При всех превращениях гидроксикислот приходится считаться с взаимным влиянием гидроксильной и карбоксильной групп. Особенно это влияние велико, если эти группы находятся в α -положении. α -Гидроксикислоты обнаруживают ряд специфических реакций, обусловленных взаимным влиянием гидроксильной и карбоксильной групп. 3.1. Восстановление α-гидроксикислот. α- гидроксикислоты легко восстанавливаются в карбоновые кислоты, например при действии иодоводорода:
СН3―СНOH―COOH + 2HI → CH3―CH2―COOH + I2 + H2O
3.2. Нагревание α-гидроксикислот. При кипячении с разбавленными кислотами α -гидроксикислоты расщепляются с выделением муравьиной кислоты и соответствующенго альдегида:
СН3―СН(OH)―COOH → CH3―COН + HCOOH 3.3. Реакция дегидратации α-, β- и γ-гидроксикислот. Реакция отщепления воды позволяет различить α -, β - и γ -гидроксикислоты. Образование лактидов. α -Гидроксикислоты при нагревании отщепляют воду с образованием лактидов. Лактидами называются циклические эфиры, построенные из двух и более остатков гидроксикислот. При нагревании этих кислот в результате межмолекулярной этерификации образуется димерный продукт, легко превращающийся в более устойчивый шестичленный циклический диэфир – лактид:
Название лактидов включает корень тривиального латинского названия гидроксикислоты, суффикс – ид и умножающий префикс ди -, три- и т.д., указывающий число молекул, образующих лактид.
Образование непредельных кислот. β - гидроксикислоты теряют воду и дают непредельные кислоты. Такое направление дегидратации связано с повышенной подвижностью водородных атомов в соседстве с карбоксильной группой, обусловленной устойчивостью (благодаря сопряжению) соответствующего аниона:
Образование лактонов. При нагревании в кислой среде, а иногда просто при стоянии в растворе, γ- и δ-гидроксикислоты подвергаются внутримолекулярной этерификации с образованием пяти- и шестичленных лактонов, например:
Лактонами называются внутренние сложные эфиры гидрксикислот, т.е. соединения, в которых сложноэфирная группировка ―С(О)О― включена в циклическую структуру. Легкость лактонизации γ- и δ- гидроксикислот объясняется повышенной термодинамической устойчивостью пяти- и шестичленных циклических соединений. Циклы меньшего или большего размера в этих условиях не образуются. По номенклатуре ИЮПАК лактоны, образованные из алифатических кислот, называют, добавляя суффикс –олид к названию углеводорода с тем же числом атомов углерода. Цифрой указывают место замыкания цикла, начиная нумерацию от карбонильного атома углерода. Так, приведенный выше, γ- бутиролактон имеет систематическое название 4-бутанолид.
Отдельные представители. Молочная кислота CH3CH(OH)COOH была впервые обнаружена К.В.Шееле (1780) в прокисшем молоке, отсюда и получила название. Благодаря наличию в молекуле асимметрического атома углерода молочная кислота может существовать в виде двух оптически активных энантиомеров – D- и L-форм – и оптически неактивной рацемической формы. Последняя представляет собой молочную кислоту брожения. L(+)–Молочная кислота, образуется в мышечной ткани как продукт расщепления и дальнейшего превращения полисахарида гликогена. D(-)–Молочная кислота может быть получена под действием микроорганизмов. Соли и сложные эфиры молочной кислоты называются лактатами. Лактат кальция, лактат железа применяются в медицинских целях. Концентрированные растворы молочной кислоты используют для прижиганий.
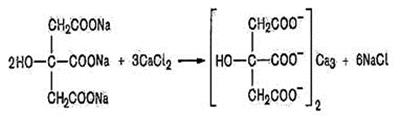
Лимонная кислота HOOCCH2C(OH)(COOH)CH2COOH, т.пл. 1530С – наиболее распространенная гидрокситрикарбоновая кислота. Она содержится в плодах цитрусовых (в лимонах её 6-8% от сухой массы), некоторых ягодах и фруктах. Лимонная кислота и её соли (цитраты) широко используются в пищевой промышленности и фармации. Цитрат натрия применяется для консервации донорской крови. Противосвертывающее действие основано на том, что цитрат натрия связывает участвующие в процессе свертывания ионы кальция в нерастворимый цитрат кальция. Качественная реакция на лимонную кислоту и ее соли: реакция с хлоридом кальция. Реакцию проводят в нейтральной среде при кипячении:
Выпадает белый осадок цитрата кальция.
Вопросы с эталоном решения.
34. Предложите схему синтеза молочной кислоты из 2-хлорпропановой кислоты. Обладает ли полученная кислота оптической активностью? Какой продукт образуется при нагревании молочной кислоты? Напишите схему реакции.
Решение-34: Гидроксикислоты получают из галогенкарбоновых кислот в результате обработки их щелочью с последующим взаимодействием образующейся соли гидроксикислоты с кислотой:
Благодаря наличию в молекуле асимметрического атома углерода она может существовать в виде двух оптически активных энантиомеров:
Так как молочная кислота относится к α-гидроксикислотам, то она при нагревании образует устойчивый шестичленный циклический диэфир-лактид:
35. Какое соединение образуется при нагревании 3- гидроксибутановой кислоты? Объясните, почему при нагревании этой кислоты невозможна внутри- и межмолекулярная этерификация? Решение-35: 3-гидроксибутановая кислота относится к β-гидроксикислотам, а этим кислотам при нагревании или под действием минеральных кислот характерны реакции дегидратации с образованием α,β-ненасыщенных кислот:
Внутри- или межмолекулярная этерификация в этом случае невозможна, так как она привела бы к образованию неустойчивого четырех- или восьмичленного цикла (лактона и лактида соответственно).
36. Напишите схему реакций взаимодействия β-гидроксикислоты с гидроксидом натрия, этанолом и аммиаком. Назовите продукты реакции. Решение-36: Наличие в молекуле гидроксикислот карбоксильной и гидроксильной групп приводит к тому, что эти соединения вступают в реакции, свойственные как спиртам, так и кислотам. С гидроксидом натрия, этанолом и аммиаком реакции идут по карбоксильной группе:
6. Вопросы для самостоятельного решения. 37. Назовите по заместительной номенклатуре следующие соединения: а) HOCH2CH(OH)COOH б)(CH3)2 CH(OH)COOH 38. Какие галогенозамещенные кислоты следует взять для получения яблочной (2-гидроксибутановой),миндальной(2-гидроксифенилуксусной) кислот. 39. Напишите схемы реакций образования гидротартрата и тартрата калия. 40. В чём проявляется оптическая активность? Как называются стереоизомеры, обладающие оптической активностью? Что такое энантиомеры, диастереомеры? На примере винной кислоты укажите пару энантиомеров и пару диастереомеров:
41. Приведите проекционные формулы Фишера а)винной (2,3-дигидроксибутандиовой) б) яблочной (2-гидроксибутановой) кислот.
42. Какой структурный фрагмент в молекуле винной кислоты может образовывать комплексную соль меди (II)? 43. Какой химический процесс происходит при нагревании молочной кислоты с концентрированной серной кислотой? Напишите схему реакции. 44. Напишите схемы реакций кислотного и щелочного гидролиза γ-бутиролактама. IV.Фенолокислоты Общая характеристика. Из ароматических гидроксикислот наибольшее значение имеют фенолокислоты, у которых гидроксильные группы непосредственно связаны с бензольным кольцом (фенольные гидроксильные группы). Изомерия фенолокислот обусловлена взаимным расположением –ОН и –СООН групп. По систематической номенклатуре при формировании названия фенолокислот за родоначальную структуру принята бензойная кислота; наличие –ОН группы отражается префиксом гидрокси- (окси-). Для многих фенолокислот употребляются тривиальные названия – салициловая, галловая и др. Способы получения Фенолокислоты чаще всего получают прямым карбоксилированием фенолов, т.е. непосредственным введением –СООН группы. При взаимодействии сухого феноксида натрия с СО2, который при обработке минеральной кислотой превращается в салициловую к-ту:
Реакция протекает по механизму SЕ. Поскольку СО2 является слабым электрофилом, непосредственно в реакцию с фенолом он не ступает. Для активации бензольного кольца фенол превращают в феноксид натрия. Отрицательно заряженный атом кислорода феноксид-иона проявляет значительно более сильные электронодонорные свойства, чем неионизированная –ОН группа. Поэтому в феноксид-ионе бензольное кольцо обладает большой активностью в реакциях электрофильного замещения.
Химические свойства Фенолокислоты являются сильными кислотами. Сила салициловой кислоты кислоты возрастает за счет образования внутримолекулярной Н–связи
Салициловая кислота обладает более кислотными свойствами, чем ее мета- и пара-изомеры.
|
|||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 116; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.22.135 (0.022 с.) |