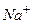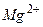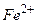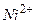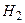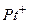Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Возникновение двойного электрического слоя
Рассмотрим металл, погруженный в водный раствор своей собственной соли, например, цинк, находящийся в водном растворе сульфата цинка Вместе с тем, ионы Если поток ионов
Если поток ионов Таким образом, если какой-либо металл помещен в раствор электролита, то на металле и в электролите появляются заряды противоположного знака. В состоянии электрохимического равновесия, когда потоки ионов металла из электрода в раствор и обратно становятся равными друг другу, металл получает относительно электролита электрический потенциал, называемый электродным потенциалом. Электродный потенциал
где Абсолютную величину электродного потенциала измерить невозможно, так как для вольтметра нужен второй электрод, помещаемый в электролит. Поэтому всегда измеряют разность потенциалов исследуемого электрода и некоторого стандартного электрода сравнения. В качестве электрода сравнения используют водородный электрод (насыщенная водородом платиновая пластина, погруженная в раствор кислоты).
Таблица стандартных электродных потенциалов относительно водородного потенциала
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 143; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.38.142 (0.006 с.) |
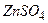 . На границе цинк-раствор ионы
. На границе цинк-раствор ионы 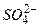 взаимодействуют с ионами металла
взаимодействуют с ионами металла 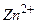 , образуя
, образуя  и освобождая в металле отрицательный заряд
и освобождая в металле отрицательный заряд 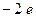 (рис. 11.5, а).
(рис. 11.5, а).
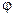 зависит от концентрации C раствора по следующей формуле:
зависит от концентрации C раствора по следующей формуле: ,
, - абсолютный нормальный электродный потенциал (потенциал равновесия для раствора, содержащего 1 кмоль ионов в объеме
- абсолютный нормальный электродный потенциал (потенциал равновесия для раствора, содержащего 1 кмоль ионов в объеме 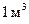 ), k - постоянная Больцмана, Т - абсолютная температура.
), k - постоянная Больцмана, Т - абсолютная температура. в вольтах:
в вольтах: