Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гальванический элемент. Гальванизм в полости рта
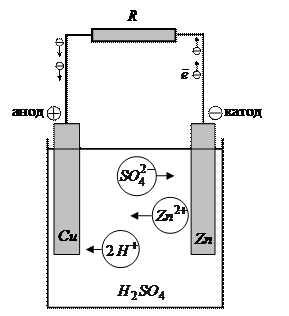
Гальваническим элементом называют два разных проводника, помещенных в общий электролит. Простейший гальванический элемент - элемент Вольты. Он состоит из медной и цинковой пластин, погруженных в слабый водный раствор серной кислоты однонормальной концентрации (рис. 11.6). Медь заряжается положительно (представляя собой анод «+»), а цинк отрицательно (катод «-»). Разность потенциалов между электродами разомкнутого элемента (т.е. в отсутствии электрического тока) называется электродвижущей силой (ЭДС) гальванического элемента
Если замкнуть электроды гальванического элемента на проводнике с сопротивлением R, то электроны по внешнему участку цепи начнут движение от отрицательного полюса (цинка) к положительному (меди). Цинк станет менее отрицательным, чем нужно для электрохимического равновесия между ним и раствором. Вследствие этого ионы Таким образом, в замкнутом элементе положительные ионы движутся от катода к аноду (противоположно движению ионов при электролизе), а отрицательные ионы в обратном направлении. Известно, что при наличии в полости рта зубопротезных включений из двух и более разнородных металлов у пациентов возникают симптомы гальванизма: «жжение», «покалывание», «наличие металлического привкуса» и т.д. Причина данного симптома заключается в том, что разнородные металлы (например, железо и золото), помещенные в общий электролит (слюну), образуют химический источник тока (гальванический элемент). Возникающие в полости рта электрические токи распространяются как по поверхности слизистой оболочки, так и в тканях. Электропроводность слюны и межклеточной жидкости обусловлена наличием большого количества различных ионов (
Электрохимическая коррозия Коррозия - самопроизвольное разрушение металлических материалов в результате химического или электрохимического взаимодействия с окружающей средой. Наиболее часто коррозионный процесс представляет собой окисление металла с образованием ионов металла, которые при дальнейших превращениях дают различные продукты. Электрохимической коррозией называют разрушение металла (или сплава) в результате возникающих в среде гальванических элементов. Электрохимическая коррозия может возникать при взаимодействии зуботехнического материала с жидкостями полости рта, содержащими электролиты. В этом случае роль электролита играет слюна на металлической поверхности, в которой растворены электропроводящие примеси. Электродами являются сам металл и содержащиеся на его поверхности примеси. В таком гальваническом элементе примеси, имеющие бóльшее значение электродного потенциала, представляют собой анод, а сам металл является катодом. На аноде обычно выделяется водород из молекул или ионов среды, а катод растворяется, т.е. подвергается коррозии (рис. 11.7).
Различают следующие виды электрохимической коррозии: а) равномерная или общая, б) межкристаллитная, в) коррозионное растрескивание. Равномерной коррозией называется такой вид коррозии, когда разрушение металла или сплава происходит по всей поверхности. Она наименее опасна, так как мало влияет на механическую прочность. В полости рта такой тип коррозии отмечается при использовании протезов, паянных серебряными припоями. Для количественной оценки общей коррозии применяют следующие показатели: 1) скорость коррозии K, 2) величина проникновения коррозии:
где
Шкала коррозионной устойчивости сплава:
Межкристаллитное растрескивание представляет собой сложный процесс локализованного разрушения металла, протекающий в условиях одновременного воздействия статических напряжений и электрохимического процесса. По характеру защитного действия против электрохимической коррозии различают анодные и катодные покрытия. Глава 12
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 100; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.198.21 (0.008 с.) |
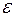 . Для элемента Вольты, составленного из цинкового и медного электродов, ЭДС равна:
. Для элемента Вольты, составленного из цинкового и медного электродов, ЭДС равна: ;
;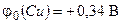 ;
; .
.
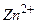 будут выходить в раствор и двигаться от катода. С другой стороны, электроны, приходящие на медный электрод, будут уменьшать его положительный потенциал, и поэтому ионы
будут выходить в раствор и двигаться от катода. С другой стороны, электроны, приходящие на медный электрод, будут уменьшать его положительный потенциал, и поэтому ионы 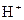 из раствора серной кислоты будут двигаться к аноду и выделяться на нем. В результате на катоде происходит реакция окисления
из раствора серной кислоты будут двигаться к аноду и выделяться на нем. В результате на катоде происходит реакция окисления  , тогда как на аноде реакция восстановления
, тогда как на аноде реакция восстановления 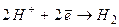 .
.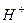 ,
, 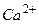 ,
, 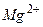 и др.). Выявление металлических включений, вызывающих патологические гальванические токи, с целью их последующего устранения имеет большое значение для практической стоматологии.
и др.). Выявление металлических включений, вызывающих патологические гальванические токи, с целью их последующего устранения имеет большое значение для практической стоматологии.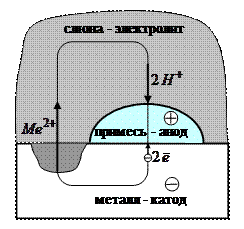
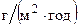 - величина, характеризующая потерю массы (при удалении продуктов коррозии с поверхности металла или сплава) в течение определенного промежутка времени, отнесенной к единице поверхности;
- величина, характеризующая потерю массы (при удалении продуктов коррозии с поверхности металла или сплава) в течение определенного промежутка времени, отнесенной к единице поверхности;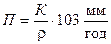 ,
, - плотность металла,
- плотность металла, 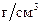 .
.