
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрический ток в электролитах.
Контактные явления Электролиз Электролиты - это вещества, которые в растворах распадаются на ионы. Распад молекул растворенного вещества на ионы в результате взаимодействия с молекулами растворителя называется электролитической диссоциацией. Пусть какое-либо вещество, молекулы которого образованы за счет ионной связи, например,
где
Поместим в раствор электролита (например, раствор
Запишем уравнения соответствующих реакций:
на катоде: на аноде:
Процесс выделения веществ, входящих в состав электролита, в результате прохождения по нему электрического тока называется электролизом. Следует отметить, что, выделяющийся на катоде водород способен посылать свои ионы обратно в раствор, отчего в цепи между электродами возникает дополнительная разность потенциалов, направленная противоположно внешнему приложенному напряжению. Данное явление получило название электрохимической поляризации. Для устранения влияния электрохимической поляризации используют неполяризующиеся электроды, изготовленные из металла, погруженного в раствор, который образует ион металла того же металла (например, в раствор соли того же металла).
|
|||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 71; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.206.68 (0.006 с.) |
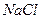 , растворено в воде. Полярные молекулы воды, обладающие большим дипольным моментом, своим электрическим полем настолько ослабляют связь ионов
, растворено в воде. Полярные молекулы воды, обладающие большим дипольным моментом, своим электрическим полем настолько ослабляют связь ионов 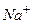 и
и  , что в результате какого-либо случайного соударения молекула
, что в результате какого-либо случайного соударения молекула 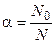 ,
,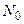 - число молекул, распавшихся на ионы,
- число молекул, распавшихся на ионы,  - число молекул, помещенных в раствор.
- число молекул, помещенных в раствор.
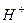 движутся к катоду "–", а отрицательные ионы (анионы)
движутся к катоду "–", а отрицательные ионы (анионы) 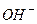 к аноду "+". Достигая анода, ионы хлора отдают ему свой электрон и превращаются в атомы хлора. Часть атомов хлора соединяются в молекулы и выделяются в виде пузырьков газа. Положительные ионы натрия и водорода, напротив, движутся к катоду. Ионы водорода заимствуют от катода по одному электрону, становятся атомами водорода и затем, образовав молекулу, выделяются в виде пузырьков на электроде. В свою очередь, ионы натрия взаимодействуют с водой с образованием едкой щелочи.
к аноду "+". Достигая анода, ионы хлора отдают ему свой электрон и превращаются в атомы хлора. Часть атомов хлора соединяются в молекулы и выделяются в виде пузырьков газа. Положительные ионы натрия и водорода, напротив, движутся к катоду. Ионы водорода заимствуют от катода по одному электрону, становятся атомами водорода и затем, образовав молекулу, выделяются в виде пузырьков на электроде. В свою очередь, ионы натрия взаимодействуют с водой с образованием едкой щелочи.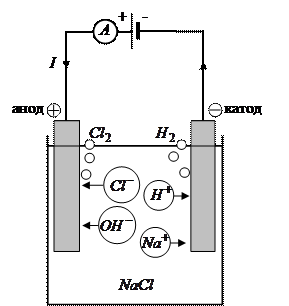
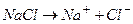 ,
, 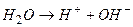 ;
;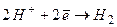 ;
;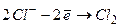 .
.


