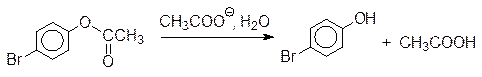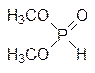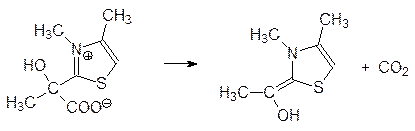Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Эффект сближения реагирующих групп
Одна из главных особенностей ферментативного катализа заключается в эффекте сближения реагирующих групп. В результате взаимодействия субстрата с его окружением в активном центре реагирующие группы оказываются в наиболее благоприятном для протекания реакции положении. Этот эффект наблюдается и в обычной органической химии. Так, например, реакция гидролиза п ‑бромфениловых эфиров карбоновых кислот катализируется карбоксилатными ионами:
Если скорость гидролиза п -бромфенилацетата в присутствии эквивалентного количества ацетата натрия принять за единицу, то соль моно- п -бромфенилового эфира глутаровой кислоты гидролизуется примерно в 1000 раз быстрее, в 2,2×105 раза быстрее гидролизуется соль соответствующего моноэфира янтарной кислоты:
Для моно- п -бромфенилового эфира малеиновой кислоты скорость гидролиза возрастает в 107 раз. Интересно, что для солей моно- п -бромфениловых эфиров некоторых 2,2‑дизамещенных глутаровых кислот скорость гидролиза может увеличиваться в 3×1018 раз. Это связано с уменьшением степеней свободы при вращении молекул, что обеспечивает оптимальное расположение катализирующей гидролиз анионной карбоксилатной группы около сложноэфирной группы. Еще один пример рассматриваемого эффекта представлен реакцией гидролиза гликозидов 2-гидроксибензойной кислоты (салициловой) и 4-гидроксибензойной кислоты. Скорость гидролиза первого соединения на 4 порядка выше, чем второго:
Здесь очевидна каталитическая роль кислотной группы, которая у производного салициловой кислоты находится непосредственно у аномерного (гликозидного) атома кислорода. И последний пример: известно, что прямая реакция этерификации фенола карбоновыми кислотами идет крайне медленно, но в то же время 2‑гидроксикоричная кислота циклизуется в лактон (кумарин) даже в щелочной среде:
Дестабилизация связей Известно, что изменение геометрии связей приводит к их дестабилизации. В качестве примера можно привести гидролиз циклического и ациклического фосфитов: константа скорости гидролиза этиленфосфита на семь порядков больше константы скорости гидролиза диметилфосфита:
что связано с разной геометрией связей в этих двух соединениях. К этой же группе возможных влияний относится и изменение характера сольватации промежуточных продуктов или переходных состояний. Этот эффект иллюстрируется реакцией декарбоксилирования продукта присоединения пировиноградной кислоты к соли диметилтиазолия, имитирующей in vitro тиаминпирофосфат – кофермент пируватдекарбоксилазы:
В воде продукт присоединения пирувата достаточно устойчив, в спирте скорость декарбоксилирования возрастает на 4–5 порядков, а в полярном апротонном диметилсульфоксиде скорость декарбоксилирования не удается измерить, так как уже при растворении в нем продукта присоединения происходит вспенивание от выделяющегося диоксида углерода.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 84; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.86.138 (0.005 с.) |