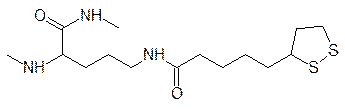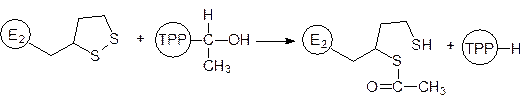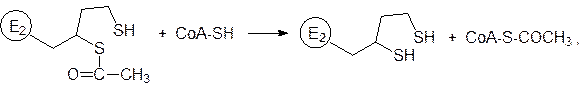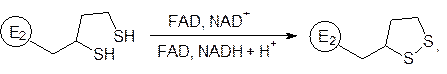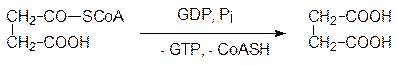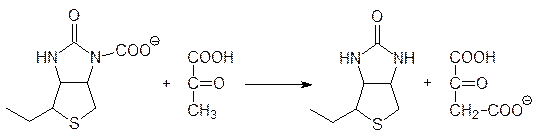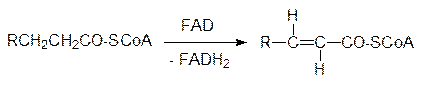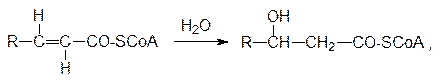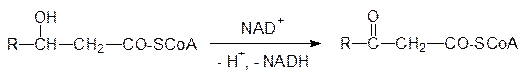Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительное декарбоксилирование пирувата
В аэробных условиях превращение пирувата идет на пируватдегидрогеназном мультиферментном комплексе, работу которого обеспечивают три фермента: пируватдегидрогеназа (Е1), дигидролипоилацетилтрансфераза (Е2) и дигидролипоилдегидрогеназа (Е3), объединенные в частицы диаметром около 45 нм. Комплекс включает пять коферментов и простетических групп (тиаминпирофосфат, липоевая кислота, кофермент А, флавинадениндинуклеотид и никотинамидадениндинуклеотид). Из них только липоевая кислота образуется в организме животных из обычных метаболитов, тогда как тиамин (в тиаминпирофосфате), рибофлавин (в FAD), пантотеновая кислота (в коферменте А) и никотинамид (в NAD+) должны поступать в организм животных в виде витаминов. Не нуждающийся в кислороде гликолиз идет в цитозоле клетки, но основные аэробные биоэнергетические процессы протекают в матриксе митохондрий, отделенном от цитозоля двумя мембранами. Через внешнюю мембрану митохондрий легко проходят все вещества с молекулярной массой до 10000, а для транспорта через внутреннюю мембрану существуют транспортные системы, одна из которых предназначена для переноса молекул пировиноградной кислоты. Окислительное декарбоксилирование пирувата начинается с присоединения его к тиаминпирофосфату так, как это было представлено выше для процесса спиртового брожения, но образовавшаяся после декарбоксилирования пирувата 1‑гидроксиэтильная группа не отщепляется в виде альдегида, а переносится на один из атомов серы дитиоланового цикла липоевой кислоты в виде ацетата и атома водорода. Остаток липоевой кислоты присоединен к ферменту через аминогруппу лизинового фрагмента белковой молекулы (простетическая группа):
Декарбоксилированный тиамином остаток пировиноградной кислоты переносится на дитиолановый фрагмент по схеме:
Ацетилированный фрагмент дигидролипоилацетилтрансферазы маятниковым движением отходит от тиаминпирофосфатного участка мультиферментного комплекса и отдает ацетильный остаток коферменту А:
Движение остатка дигидролипоевой кислоты после переноса ацетильной группы на кофермент А завершается у дегидрогеназного участка мультиферментного комплекса, где атомы водорода двух сульфгидрильных групп переходят на никотинамидадениндинуклеотид (посредником при этом является флавинадениндинуклеотид):
Образовавшийся при этом в результате дегидрирования дитиолановый цикл возвращается к тиаминпирофосфатному участку для того, чтобы снова принять гидроксиэтильный остаток в виде ацетильной группы и атома водорода. Процесс превращения пировиноградной кислоты в ацетилкофермент А необратим. При включении в обмен веществ меченного по углероду угольного ангидрида радиоактивная метка никогда не обнаруживается в пировиноградной кислоте. Цикл Кребса Последовательность превращений ацетильного остатка, образовавшегося после декарбоксилирования пирувата, была открыта в 1937 г. немецким биохимиком X. Кребсом, эмигрировавшим в 1933 г. в Великобританию. Чаще всего это многостадийное циклическое превращение называют по имени открывшего его ученого, но можно также встретить такие названия, как «цикл лимонной кислоты» или «цикл трикарбоновых кислот». Открытие цикла Кребса было отмечено Нобелевской премией 1953 г. Кребс разделил ее с Ф. Липманном, открывшим аденозинтрифосфатный цикл. В основу расшифровки биохимических превращений цикла Кребса легли наблюдения за обменными процессами в мышечных тканях. В них и раньше обнаруживали незначительные количества дикарбоновых кислот (янтарной, фумаровой, яблочной, щавелевоуксусной), а также трикарбоновых кислот (лимонной, цис -аконитовой, изолимонной). Добавки этих кислот к клеткам мышечной ткани вызывали заметное увеличение потребления ими кислорода, а малоновая кислота останавливала течение аэробных обменных процессов, вызывая в клетках накопление лимонной, кетоглутаровой и янтарной кислот. Кребс установил также, что инкубация мышечных клеток с пировиноградной и щавелевоуксусной кислотами приводит к росту концентрации в них лимонной кислоты. Эти наблюдения легли в основу представлений о циклическом пути превращений, в ходе которых на начальном этапе из щавелевоуксусной кислоты (анион оксалоацетат) образуется лимонная кислота, а конечным продуктом превращений лимонной кислоты является щавелевоуксусная кислота, с которой этот процесс начинался.
На первой стадии цикла Кребса фермент цитратсинтаза катализирует образование лимонной кислоты (анион цитрат) из ацетилкофермента А и оксалоацетата по схеме:
В учебниках по биохимии принято представлять и называть кислоты как анионы, акцентируя этим внимание на то, что в живых клетках поддерживается слабощелочная среда, но для лучшего понимания химизма процессов здесь и далее будут использоваться традиционные для химиков уравнения реакций. Суть представленной реакции состоит в том, что в тиоэфирах карбоновых кислот атомы водорода в a‑положении к карбонильной группе соответствуют по реакционной способности аналогичным атомам водорода в карбонильных соединениях. В соответствии с этим реакция образования лимонной кислоты подобна реакции альдольной конденсации. Первичным продуктом этой реакции является, конечно, цитроилкофермент А, но скорость его гидролиза выше скорости образования и поэтому обнаружить его в клетках не удается. После этого лимонная кислота при катализе цис -аконитазой превращается в изолимонную кислоту в результате обратимого отщепления и присоединения молекулы воды с образованием в качестве промежуточного продукта цис -аконитовой кислоты:
Цис -аконитаза – это металлопротеин с ионом железа Fe2+. Превращение цис ‑аконитовой кислоты в изолимонную идет против правила Марковникова, и действительно в равновесном состоянии концентрация лимонной кислоты примерно на порядок превышает концентрацию изолимонной, однако в дальнейшем превращении участвует только изолимонная кислота. При дегидрировании изолимонной кислоты образуется трикарбоновая кетокислота, которая сразу декарбоксилируется и превращается в кетоглутаровую кислоту:
Далее ферментная система, аналогичная пируватдегидрогеназному мультиферментному комплексу, превращает кетоглутаровую кислоту в сукцинилкофермент А:
Тиоэфирная связь в этом соединении делает его макроэргическим, поэтому превращение сукцинилкофермента А в анион янтарной кислоты (сукцинат) сопровождается образованием другого макроэргического вещества, аналога аденозинтрифосфата – гуанозинтрифосфата (ГТФ, GTP).
Янтарная кислота дегидрируется FAD-зависимым ферментом с образованием фумаровой кислоты, которая превращается в L -яблочную кислоту (анион малат) в результате гидратации фумаразой (см. стр. 117):
И, наконец, NAD+-зависимый фермент L -малатдегидрогеназа переводит яблочную кислоту в оксалоацетат, с реакции которого с ацетилкоферментом А начиналась эта цепочка превращений:
Роль щавелевоуксусной кислоты в биохимии не ограничивается участием в цикле Кребса. Она может быть предшественником аспарагиновой кислоты и аспарагина (правда, она может быть также получена из этих аминокислот). Для иных обменных процессов из цикла Кребса могут изыматься и другие его участники, например, кетоглутаровая кислота для образования глютаминовой кислоты и глютамина. Кроме того, щавелевоуксусная кислота – это исходный продукт для образования глюкозы при недостатке ее в пище. Не исключены также просто сбои в системе транспорта и превращений участвующих в цикле Кребса веществ, которые приводят к потере оксалоацетата. Поэтому должен существовать автономный механизм образования оксалоацетата. Этот биохимический процесс относится к анаболическим, но он является неотъемлемой частью цикла Кребса, и поэтому есть смысл рассмотреть его в этом разделе.
Процессы, в которых образуются промежуточные продукты многостадийных биохимических превращений, в общем случае называют анаплерозом. Исходным продуктом для образования оксалоацетата является пируват, который карбоксилируется бикарбонатным анионом с участием аденозинтрифосфата в каталитическом центре соответствующей карбоксилазы. Положительным эффектором этого фермента служит ацетилкофермент А, то есть в отсутствии в клетках свободного ацетилкофермента А биосинтез оксалоацетата из пирувата не идет. Механизм кабоксилирования биотинзависимыми ферментами рассматривался выше (см. стр. 108). В данном случае гетероциклический структурный элемент биотина, несущий карбоксилатную группу, перемещается в другой участок каталитического центра и там отдает ее пирувату с образованием оксалоацетата:
Катаболизм жирных кислот Важным источником энергии в живой природе являются триглицериды жирных кислот, при биологическом окислении которых генерируется около 9 ккал/г (в среднем человек расходует в сутки около 2800 ккал). Как отмечалось выше, возможность накопления источника энергии в виде гликогена ограничена, тогда как жиры могут накапливаться многоклеточными организмами в количествах, обеспечивающих, например, зимнюю спячку грызунов и медведей или тысячекилометровые перелеты птиц. Жиры запасаются в специализированных клетках (адипоцитах) и транспортируются жидкими средами организма с помощью транспортных белков альбуминов в гидрофобных «карманах» или же с помощью различных биогенных поверхностно-активных веществ. В желудочно-кишечном тракте животных жиры эмульгируются желчными кислотами и гидролизуются секретируемыми поджелудочной железой липазами на жирные кислоты, диацилглицерины и моноацилглицерины, которые всасываются стенками тонкого кишечника (плазма крови человека после сытной трапезы похожа на молоко). Отделившиеся от альбуминов жирные кислоты проходят через клеточные мембраны и попадают в цитозоль, где с участием аденозинтрифосфата ацилируют кофермент А по обычной схеме в присутствии ацил-СоА-синтетаз:
В обычных условиях равновесие этой реакции сдвинуто влево, например, такие макроэргические соединения, как тиоэфиры карбоновых кислот, используются клетками для биосинтеза АТФ и ГТФ (см. на стр. 142 превращение сукцинил-СоА), но пирофосфатаза гидролизует пирофосфат на две молекулы фосфорной кислоты и реакция становится необратимой.
Катаболические превращения жирных кислот протекают во внутренней среде (матриксе) митохондрий – клеточных органелл с двумя мембранами. Ацилированные жирными кислотами молекулы кофермента А проходят через внешнюю мембрану в межмембранное пространство с помощью простой диффузии, тогда как для преодоления внутренней мембраны митохондрий подключается дополнительное вещество – «челнок» – карнитин, образующийся из аминокислоты лизина по многостадийной схеме, включающей реакции метилирования концевой аминогруппы, гидроксилирования и укорочения углеродной цепи. В результате генетических нарушений может быть нарушен механизм образования карнитина или транспорт ацилкарнитина в митохондрии. У людей с таким нарушением в обмене веществ происходит ожирение мышечной ткани, сопровождающееся болевыми ощущениями в мышцах. Фермент карнитинацилтрансфераза I на внешней стороне внутренней мембраны митохондрий осуществляет реакцию:
После этого ацилированный карнитин соответствующей транслоказой перемещается в матрикс митохондрий, где другой фермент карнитинацилтрансфераза II переносит ацильный остаток в обращение предыдущей реакции на внутримитохондриальный кофермент А, а карнитин снова выводится в межмембранное пространство митохондрий. Такой усложненный транспорт нужен для того, чтобы разделить кофермент А внутри и вне митохондрий, поскольку иначе живой природе пришлось бы находить возможность определения уровня кофермента А по разные стороны мембраны и выведения из митохондрий только тех его молекул, которые поступили в виде тиоэфиров с жирной кислотой. Окисление жирных кислот начинается с реакции дегидрирования ацилкофермента А ацил-СоА-дегидрогеназой по схеме:
Затем еноил-СоА-гидратаза превращает тиоэфир транс -изомера a,b‑ненасыщенной кислоты в L -3-гидроксиацил-СоА:
а 3-гидроксиацил-СоА-дегидрогеназа превращает его в 3-кетоацил-СоА:
Образовавшееся b-дикарбонильное соединение расщепляется по С–С‑связи коферментом А. Поскольку эта реакция представляет собой тиолиз (разрыв связи сульфгидрильной группой), катализирующий ее фермент называется тиолазой:
В результате этих превращений молекула жирной кислоты становится короче на два атома углерода, то есть это превращение соответствует b‑окислению. Повторение представленных выше ферментативных реакций на жирной кислоте с четным числом атомов углерода (основные кислотные компоненты жиров) приведет в конце концов к ацетоацетил-СоА, который расщепляется коферментом А в присутствии тиолазы на две молекулы ацетил-СоА, встраивающиеся, как и полученные на предыдущих стадиях, в цикл Кребса.
Если учесть все протекающие биохимические реакции, включая участие ацетильных остатков в цикле Кребса и окислительное фосфорилирование (см. гл. 8.) генерируемого в b-окислении и в цикле Кребса восстановительного потенциала, то катаболизм одной молекулы пальмитиновой кислоты приведет к образованию 106 молекул аденозинтрифосфата (АТФ), при этом суммарный КПД будет равен 33%. Или иначе: при окислении одного моля (256 г) пальмитиновой кислоты образуется 45000 г АТФ. В живой природе реализуется также механизм a-окисления. В частности, в состав липидов клеток мозга входят a-гидроксизамещенные жирные кислоты, образующиеся при окислении жирных кислот монооксигеназами. При их дегидрировании получаются высшие a-кетокислоты, которые подвергаются окислительному декарбоксилированию кислородом в присутствии ионов Fe2+ и аскорбиновой кислоты, то есть по механизму, который отличается от описанного выше превращения пирувата и кетоглутарата. Образовавшиеся при этом кислоты с нечетным числом атомов углерода в цепи в результате b-окисления превращаются в пропионил-СоА, который карбоксилируется биотинзависящим ферментом в метилмалонил-СоА, изомеризующийся кобаламинзависимым ферментом с образованием участвующего в цикле Кребса сукцинил-СоА (см. стр. 108–109). Для катаболического превращения ненасыщенных жирных кислот, входящих в состав жиров и липидов мембран, нужны дополнительные ферменты. Дело в том, что последовательное b‑окисление (например олеилкофермента А) приводит к соответствующему тиоэфиру цис -додец-3-еновой кислоты (цис -D3-С12-кислоты), тогда как субстратом еноил-СоА-гидратазы являются соответствующие эфиры транс -D2-ненасыщенных кислот. Далее следует очередь первого дополнительного фермента – енолил-СоА-изомеразы, катализирующей превращение по схеме:
Образовавшийся тиоэфир транс -D2-С12-кислоты представляет собой обычный субстрат гидратазы. Если же катаболическому превращению подвергаются полиненасыщенные кислоты, то b‑окисление может привести к тиоэфирам цис -2-еновых кислот, которые гидратируются еноил-СоА-гидратазой. Продуктом реакции становится тиоэфир D -изомера 3‑гидроксизамещенной кислоты, и для перевода его в субстрат 3-гидроксиацил-СоА-дегидрогеназы служит 3-гидроксиацил-СоА-эпимераза. Так, например, катаболизм линоленовой кислоты в результате представленных выше превращений завершается образованием тиоэфира цис -D2-С12-кислоты, из которой L ‑3‑гидроксидеканоилкофермент А образуется по схеме, асимметрия в которой представлена условно:
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 70; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.202.54 (0.028 с.) |