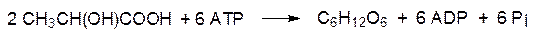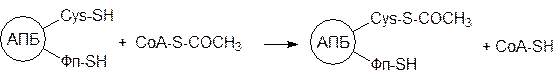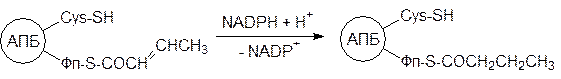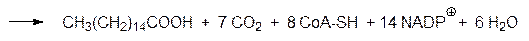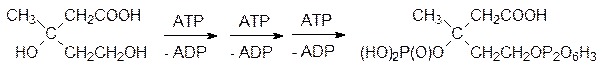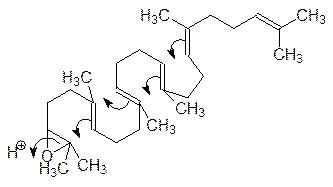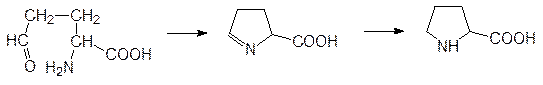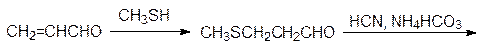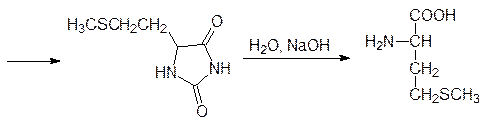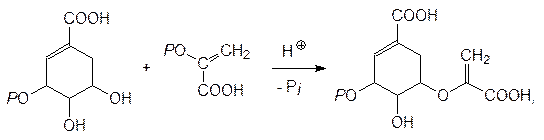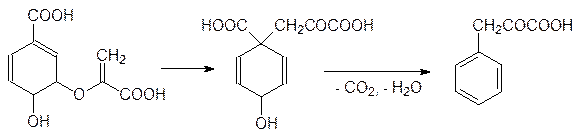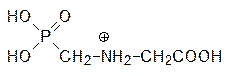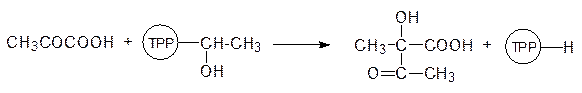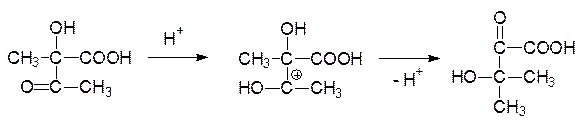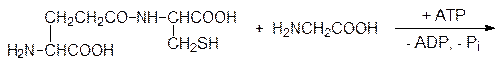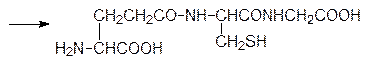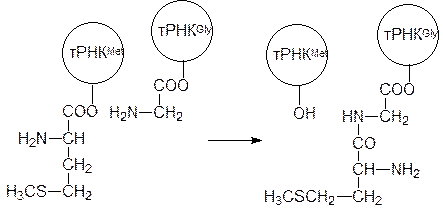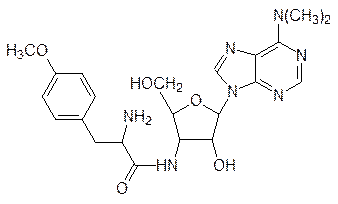Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 10. Основные анаболические процессы
Глюконеогенез Главным быстро мобилизуемым источником энергии в клетках является глюкоза, запасы которой находятся в виде крахмала и гликогена. В крови человека поддерживается постоянная концентрация глюкозы (около 5 ммоль/л), но небольшие отклонения от этого нормального уровня возможны при интенсивной работе или после еды. Глюкоза поступает в клетки из-за градиента концентраций через интегрированный в мембрану транспортный белок. Уровень глюкозы в крови поддерживается с помощью гормона поджелудочной железы инсулина и ряда других гормонов. Инсулин имеет пептидную природу, он состоит из 51 аминокислоты, но секреторные клетки (островки Лангерганса) производят проинсулин, который у разных животных содержит от 78 до 86 аминокислотных составляющих в виде одной цепочки с тремя дисульфидными связями. Активация с образованием самого инсулина происходит путем гидролитического расщепления молекулы проинсулина с элиминированием из нее центрального участка (С‑цепь) с сохранением дисульфидных связей в образовавшемся активном двухцепочечном полипептиде (А- и В‑цепи). Инсулин не проходит через клеточную мембрану, но он связывается с белком-переносчиком глюкозы и ускоряет ее диффузию в клетку. При избытке глюкозы она превращается в гликоген, а при интенсивном расходовании глюкозы она образуется из гликогена. При недостатке инсулина или при нарушении механизма поступления глюкозы в клетки организм повышает ее концентрацию в крови для того, чтобы увеличить движущую силу диффузии за счет градиента концентраций. Однако это приводит и к интенсивному выделению глюкозы почками (сахарный диабет). Испытывающие дефицит по глюкозе клетки начинают синтезировать ее из аминокислот сократительных белков, подключая к этому окислительные превращения жирных кислот. В результате этого мышечные ткани диабетиков атрофируются, и разрастается жировая ткань. Для клеток нервной системы, почек, семенников, тканей эмбриона глюкоза является единственным поставщиком энергии. Важно, что для транспорта глюкозы в нейроны инсулин не нужен, и мозг диабетиков, как и мозг здоровых людей, расходует около 120 г глюкозы в сутки. Роль глюкозы в метаболизме очевидна, но возможности депонирования ее в виде гликогена ограничены: в организме взрослого человека содержится всего лишь несколько сот граммов этого полисахарида. Поступление глюкозы с пищей (в основном в виде крахмала) не всегда соответствует действительным потребностям и поэтому организм животных в значительной мере зависит от образования глюкозы из поступающих с пищей веществ. У теплокровных избыток пищевых веществ закладывается в жировую ткань, а при недостатке глюкозы в пище на ее биосинтез расходуются белки, поскольку образующийся из жирных кислот ацетил-СоА не может превращаться в глюкозу. Ключевое вещество цикла Кребса – оксалоацетат – также не может быть получен из ацетил-СоА, поэтому правило диетологии гласит: жиры «сгорают в пламени» углеводов.
Напомним три основных положения, относящиеся к течению метаболических процессов: 1. Катаболические и анаболические пути превращения одного и того же вещества различны. Это означает, что есть по крайней мере одна стадия, по которой они не совпадают. 2. Катаболический и анаболический пути превращения одного и того же вещества контролируется различными регуляторными ферментами, но регуляция биосинтеза и биодеградации одного и того же вещества взаимосвязаны. 3. Анаболические процессы расходуют АТФ, поставляемый катаболическими процессами. Поскольку эффективность прямых и обратных превращений всегда менее 100%, на анаболический обратный путь расходуется большее количество АТФ, чем поставляемое прямым катаболическим. Это обеспечивает необратимость метаболических превращений. При изучении процесса гликолиза было установлено, что конечный продукт анаэробного превращения глюкозы – молочная кислота – может снова превращаться в глюкозу. В процессе гликолитического превращения глюкозы образованию молочной кислоты предшествует катализируемое пируваткиназой образование пирувата из фосфоенолпирувата с генерированием АТФ (АТР):
Эта реакция необратима по термодинамическим показателям, поскольку прямая реакция сопровождается выделением энергии (около 7,5 ккал/моль). Поэтому для глюконеогенеза образование фосфоенолпирувата из пирувата включает обходной путь. Сначала пируват переносится в матрикс митохондрий и карбоксилируется биотинзависимым ферментом с образованием оксалоацетата. Для его переноса в цитозоль, где идет биосинтез глюкозы, оксалоацетат восстанавливается в малат (анион яблочной кислоты), для которого существует специальная транспортная система, и уже в цитозоле малат дегидрируется с образованием оксалоацетата. Щавелевоуксусная кислота в енольной форме фосфорилируется действием ГТФ в присутствии фосфоенолпируваткарбоксикиназы с одновременным декарбоксилированием:
Хотя изменение стандартной свободной энергии при этом составляет +0,2 ккал/моль, в реальных условиях клетки этот процесс сопровождается выделением энергии (–6 ккал/моль), что делает его необратимым. В обращение процессов гликолиза фосфоенолпируват гидратируется, образовавшаяся 2-фосфоглицериновая кислота изомеризуется с переносом фосфатного остатка на концквую гидроксильную группу и восстанавливается до 3‑фосфоглицеринового альдегида, половина которого изомеризуется в фосфат диоксиацетона, после чего под действием альдолазы из фосфоглицеринового альдегида и фосфата диоксиацетона образуется 1,6‑дифосфат фруктозы. При катаболическом гликолизе идет фосфорилирование глюкозы и фосфофруктозы аденозинтрифосфатом, но обратный процесс образования АТФ из дифосфата фруктозы или фосфоглюкозы и АДФ невозможен по термодинамическим причинам, поэтому при глюконеогенезе фосфатные группы отщепляются гидролитически. Если суммарный процесс гликолиза представляется схемой:
то на обратный процесс затрачивается уже втрое больше АТФ, чем образуется в прямом процессе (поэтому около 15% образовавшейся в результате гликолиза молочной кислоты идет на энергетическое обеспечение ее превращения в глюкозу):
Процесс глюконеогенеза начинается с превращения пирувата в оскалоацетат, катализируемого пируваткарбоксилазой – аллостерическим ферментом, активируемым ацетилкоферментом А. Это означает, что при накоплении в клетке неиспользуемого ацетилкофермента А процесс биосинтеза глюкозы из пирувата интенсифицируется. В глюкозу и далее в гликоген могут превращаться все промежуточные продукты цикла Кребса. Исходными соединениями для образования глюкозы могут быть и многие аминокислоты. К глюкогенным аминокислотам относятся аланин, глютаминовая, аспарагиновая кислота и их амиды, превращающиеся (амиды после гидролиза) трансаминазами в пировиноградную, кетоглутаровую и щавелевоуксусную кислоты. Кроме того, эти кетокислоты образуются и из других аминокислот. Особенно интенсивно идет превращение аминокислот в глюкозу при недостатке инсулина. Биосинтез жирных кислот Биодеградация (b-окисление) и биосинтез жирных кислот протекают с участием двухуглеродных ацетильных фрагментов. На начальном этапе биосинтеза жирных кислот идет катализируемое ацетил-СоА-карбоксилазой карбоксилирование ацетил-СоА с образованием малонил-СоА:
Биотинзависимый фермент ацетил-СоА-карбоксилаза – это регуляторный фермент, определяющий скорость образования высших кислот. Положительным эффектором ацетил-СоА-карбоксилазы служит цитрат. Смысл этой стартовой реакции заключается в том, чтобы повысить СН-кислотность исходного продукта и облегчить реакцию наращивания углеродной цепи в последующей реакции С-ацилирования, протекающей по типу реакции сложноэфирной конденсации.
Биосинтез жирных кислот осуществляется в мультиферментной системе (она включае семь ферментов). Растущая ацильная цепь связана ковалентной связью с ацилпереносящим белком (АПБ), занимающим центральное положение в этой системе. Реакционный центр АПБ, как и в коферменте А, представлен сульфгидрильной группой цистеамина, который образует амидную связь с пантотеновой кислотой, но в отличие от кофермента А этот фрагмент АПБ (Фп–SH, Фп – фосфопантотеил) связан фосфатной группой не с аденозиновой составляющей, а с гидроксиметильной группой серинового фрагмента в молекуле АПБ:
В синтезе жирных кислот принимает участие еще одна сульфгидрильная группа молекулы АПБ (Cys–SH), но она принадлежит цистеиновому фрагменту белковой цепи. Этот фермент вместе с участвующими в биосинтезе жирной кислоты функциональными группами может быть схематически изображен следующим образом:
Синтез жирной кислоты на мультиферментном комплексе начинается с переноса ацетильной группы с ацетилкофермента А на цистеиновую тиольную группу АПБ при катализе АПБ-ацетилтрансферазой:
Затем АПБ-малонилтрансфераза переносит на вторую тиольную группу остаток малоновой кислоты от малонил-СоА:
После этого ацетильная группа по схеме внутримолекулярной сложноэфирной конденсации переносится с цистеинового остатка на фрагмент малоновой кислоты с декарбоксилированием. Этот процесс катализируется 3-кетоацил-АПБ-синтазой:
то есть трехуглеродный остаток малоновой кислоты не полностью участвует в биосинтезе жирных кислот. Он теряет карбоксилатную группу, превращающуюся в диоксид углерода, который снова включается в процесс для активации другой молекулы ацетилкофермента А. В последующих превращениях происходит восстановление ацетоацетильного остатка. Сначала NADPH восстанавливает кетогруппу до гидроксильной группы с образованием D -3-гидроксибутирилзамещенного АПБ:
Интересно, что при b-окислении жирных кислот гидроксиацилкофермент А образуется в результате гидратации двойной связи, при этом асимметричный атом углерода с гидроксильной группой имеет L -конфигурацию, а при биосинтезе жирных кислот в результате восстановления кетогруппы образуется D -3‑гидроксибутирил-замещенный АПБ, который дегидратируется с образованием транс -D2-бутеноил-АПБ:
Из этого можно сделать вывод о том, что гидратазы катаболического и анаболического путей превращения жирных кислот различны даже с учетом обратимости реакций гидратации или дегидратации, так как они различаются по одному из субстратов. При восстановлении двойной связи транс -D2-бутеноил-АПБ образуется бутирил-АПБ:
После этого образовавшийся остаток масляной кислоты переносится на цистеиновую тиольную группу
а на фосфопантетеиновую тиольную группу переносится новый малонильный остаток, и приведенный выше цикл превращений повторяется с ацилированием малонильного остатка уже не ацетильным, а бутирильным фрагментом. Этот процесс повторяется до тех пор, пока в ацильном остатке не окажется шестнадцать атомов углерода, то есть наращивание цепи идет до образования остатка пальмитиновой кислоты, который отщепляется гидролитически. Пальмитиновая кислота представляет собой конечный продукт биосинтеза в этом комплексе ферментов. Суммарно образование пальмитиновой кислоты выражается уравнением:
В состав мультиферментного комплекса, на котором протекают реакции биосинтеза пальмитиновой кислоты, входят следующие ферменты: Е1 – ацилпереносящий белок (АПБ), Е2 – ацетилтрансфераза, Е3 – малонилтрансфераза, Е4 – 3-кетоацил-АПБ-синтаза, Е5 – 3-кетоацил-АПБ-редуктаза, Е6 – 3‑гидроксиацил-АПБ-дегидратаза, Е7 – еноил-АПБ-редуктаза. Другие жирные кислоты образуются в результате наращивания или укорочения цепи пальмитиновой кислоты и реакций дегидрирования. В частности, находящаяся в клетках печени дегидрогеназа вызывает превращение стеариновой кислоты в олеиновую. Полиненасыщенные жирные кислоты синтезируются в основном клетками растений. В организм животных многие из них должны поступать с пищей. Биосинтез терпеноидов Еще один анаболический путь превращения ацетил-СоА представлен биосинтезом терпеноидов. Он начинается с образования ацетоацетил-СоА по схеме сложноэфирной конденсации, катализируемой тиолазой:
Затем другая молекула ацетил-СоА реагирует с ацетоацетил-СоА по схеме альдольной конденсации с образованием 3-гидрокси-3-метилглутарил-СоА при катализе соответствующей синтазой:
После этого гидроксиметилглутарил-СоА-редуктаза переводит этот тиоэфир дикарбоновой кислоты в дигидроксикарбоновую кислоту, называемую мевалоновой кислотой:
Соответствующие киназы переносят на гидроксильные группы этого вещества один фосфатный и один пирофосфатный фрагмент от трех молекул АТФ:
Эта фосфорилированная мевалоновая кислота отщепляет фосфат и декарбоксилируется с образованием изопентенилпирофосфата:
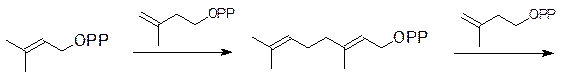
который по схеме гидрирования-дегидрирования может превращаться в диметилаллилпирофосфат. Затем идет последовательное алкилирование изопентенилпирофосфата: сначала из изопентенилпирофосфата и диметилаллилпирофосфата образуется геранилпирофосфат, далее изопентенилпирофосфат алкилируется геранилпирофосфатом с образованием фарнезилпирофосфата:
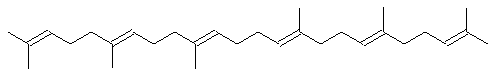
При биосинтезе стероидов две молекулы фарнезилпирофосфата соединяются по атомам углерода, несущим пирофосфатные остатки (промежуточным продуктом является прескваленпирофосфат с циклопропановым фрагментом), и образуется сквален:
Сквален окисляется скваленэпоксидазой с образованием 2,3-эпоксида, который в активном центре скваленоксидциклазы сворачивается в структуру, обеспечивающую образование тетрациклического ланостерина в результате протонирования, раскрытия эпоксидного цикла и следующих за этим атак карбокатионов по двойным связям:
Образовавшийся в результате циклизации карбокатион стабилизируется, отщепляя протон, и превращается в ланостерин с одновременной миграцией двух метильных групп:
Далее идут окислительные превращения с отщеплением метильных групп, гидрированием двойных связей, дегидрированием с образованием двойных связей и другие реакции, приводящие к образованию холестерина, эргостерина и других стероидных липидов, витамина D, стероидных гормонов, желчных кислот. Изопентенилпирофосфат и диметилаллилпирофосфат являются также исходными продуктами для образования изопреноидных заместителей в витаминах Е и К, в убихиноне; из них образуются витамин А, каротиноиды, каучук и другие полиизопрены, фитольная компонента хлорофилла и другие полипренольные остатки. Биосинтез аминокислот Растения и микроорганизмы синтезируют все белковые (протеиногенные) аминокислоты и большое число небелковых аминокислот, участвующих в биосинтезе самых разных биогенных соединений, включая, антибиотики, токсины и другие защитные молекулы. При изучении метаболизма выше уже рассматривалось образование аминокислот из a-кетокислот в результате действия трансаминаз. Так, например, биосинтезы аланина из пирувата, а также глютаминовой кислоты, глютамина, аспарагиновой кислоты и аспарагина из кетоглутарата и, соответственно, оксалоацетата протекают по схеме, представленной на стр. 150, на примере превращения кетоглуаровой кислоты глютаминовую. Достаточно простая схема реализуется при образовании пролина из глютаминовой кислоты через ее g‑полуальдегид с циклизацией в карбоксизамещенный пирролин и с восстановлением С=N‑связи:
Так же легко прослеживается путь от глицеринового альдегида к серину, а глицин образуется из серина в результате отщепления концевой гидроксиметильной группы в виде формильного фрагмента под действием тетрагидрофолатзависимого фермента (см. стр. 106). В растениях из серина образуется также цистеин в результате алкилирования сероводорода О-ацетилсерином в присутствии цистеинсинтазы:
В свою очередь цистеин в растениях служит источником серы для образования метионина, а у животных источником серусодержащих соединений служит уже эта незаменимая аминокислота. Для получения сбалансированных по аминокислотному составу кормов метионин производят в промышленном масштабе по схеме:
Окислением пропилена кислородом воздуха в присутствии катализатора на основе оксида ванадия получают акролеин, который присоединяет метилмеркаптан по олефиновой двойной связи с образованием b-метилмеркаптопропионового альдегида. Этот альдегид вступает в реакцию Бухерера–Бергса и превращается в 5‑(2‑метилмеркаптоэтил)гидантоин, который гидролизуется в присутствии щелочи при нагревании под давлением и превращается в D, L -метионин. Рацемический метионин можно разделить на стереоизомеры способом Гринштейна (ацетилирование по аминогруппе и ферментативный гидролиз ацетилазой, избирательно гидролизующей ацетилированный L -метионин), но для метионина эта операция не является обязательной, поскольку его D -изомер нетоксичен. Рассмотрение синтетических путей, ведущих ко всему разнообразию протеиногенных и небелковых аминокислот, можно ограничить схематическим представлением образования в растениях фенилаланина и аминокислот с алифатическими заместителями (валина, лейцина, изолейцина), поскольку на блокировке их биосинтеза основано гербицидное действие самых распространенных средств борьбы с сорной растительностью – глифосата и сульфонилгетерилмочевин. Образование всех ароматических соединений в растениях начинается с шикимовой кислоты, образующейся в ряде последовательных реакций из D -эритрозо-4-фосфата и фосфоенолпирувата. 5-Фосфошикимовая кислота реагирует с фосфоенолпируватом при катализе 3-еноилпирувил-5-фосфошикиматсинтазой с образованием 3‑еноилпирувил-5-фосфошикимовой кислоты:
которая отщепляет фосфат и превращается в хоризмовую кислоту:
В результате внутримолекулярного алкилирования хоризмовая кислота превращается в префеновую кислоту, которая после декарбоксилирования и дегидратации превращается в фенилпировиноградную кислоту:
Декарбоксилирование и дегидрирование префеновой кислоты приводит к 4‑гидроксифенилпировиноградной кислоте. Затем фенилпировиноградная кислота действием трансаминаз превращается в фенилаланин, а 4‑гидроксифенилпировиноградная кислота – в тирозин. Из хоризмовой кислоты через стадию образования антраниловой кислоты в клетках растений образуется триптофан. Взаимодействие фосфошикимовой кислоты с фосфоенолпируватом – одна из немногих биохимических реакций, где фосфоенолпируват реагирует в протонированном виде. Предполагалось, что используемый в качестве средства борьбы с сорной растительностью (гербицида) фосфонометилглицин (глифосат) является антиметаболитом протонированного фосфоенолпирувата:
Однако более детальные исследования показали, что сайты связывания этих веществ различны, то есть речь идет о неконкурентном ингибировании 3‑еноилпирувил-5-фосфошикиматсинтазы фосфонометилглицином. Обработка растений этим веществом приводит к их гибели в течение нескольких часов из-за нарушения биосинтеза ароматических кислот. Биосинтез валина основан на реакции алкилирования пирувата по карбонильному атому углерода гидроксиэтильным остатком, образующимся при декарбоксилировании другой молекулы пирувата на тиаминпирофосфате (ТРР), в активном центре ацетолактатсинтазы:
Молекула ацетолактата претерпевает внутримолекулярную перегруппировку: после протонирования атома кислорода карбонильной группы происходит миграция метильной группы в виде карбаниона на карбонильный атом углерода, а протон отходит от гидроксильной группы. Продуктом этой реакции становится 2‑кето-3-гидроксиизовалериановая кислота:
Образовавшаяся гидроксикетокислота в результате восстановления NADPH-зависимым ферментом превращается в 2,3-дигидроксиизовалериановую кислоту, которая дегидратируется и превращается в a-кетоизовалериановую кислоту. Трансаминаза переводит ее в валин:
a-Кетоизовалериановая кислота является также исходным продуктом для биосинтеза лейцина. По аналогии с образованием валина, но с a-кетобутиратом, образующимся из треонина, идет биосинтез изолейцина. Ключевой фермент в биосинтезе алифатических аминокислот – ацетолактатсинтаза – блокируется сульфонилгетерилмочевинами, например хлорсульфуроном (гербицид Глин):
Это средство борьбы с сорной растительностью, относящееся к третьему поколению агрохимических препаратов, имеет нормы расхода около 5 г/га. Получено также большое число его структурных аналогов, которые более избирательны и более легко подвергаются метаболической деградации в растениях и в почве. Биосинтез пептидов и белков Биоактивные пептиды, выполняющие роль специфических внутриклеточных реагентов (например, глутатион), нейромедиаторов или гормонов, синтезируются различными путями. Если в клетке должен поддерживаться постоянный уровень какого-либо короткоцепочечного пептида, то синтез его идет по обычной схеме ферментативного катализа путем последовательного ацилирования аминокислот с помощью универсального источника свободной химической энергии аденозинтрифосфата. Так, например, глютатион, который содержится во всех живых клетках и является носителем до 90% всех небелковых тиольных групп в клетках млекопитающих, синтезируется в две стадии. Сначала глютаминовая кислота и цистеин при катализе g-глютамилцистеинсинтетазой в присутствии АТФ реагируют с образованием g-глютамилцистеина; АТФ при этом разлагается на АДФ и фосфат:
Промежуточным продуктом в этой реакции является смешанный ангидрид глютаминовой кислоты по g‑карбоксильной группе и аденозиндифосфата по концевому фосфатному остатку. На второй стадии по аналогичной схеме g‑глютамилцистеин и глицин реагируют в присутствии АТФ при катализе глутатионсинтетазой с образованием этого необычного трипептида:
Однако чаще всего небольшие пептидные молекулы образуются путем гидролитического расщепления полипептидов или белков неизбирательными или специфическими ферментами. В качестве примера можно привести образование ангиотензина, октапептида с гормональной активностью, который участвует в регуляции кровяного давления. В печени образуется сывороточный белок ангиотензиноген, из которого под действием фермента ренина в почечной ткани образуется неактивный декапептид ангиотензин I (Асп–Арг–Вал–Тир–Иле–Гис–Про–Фен–Гис–Лей). При появлении необходимости в активном ангиотензине II с С-конца ангиотензина I ангиотензин-I-конвертирующий фермент, относящийся к гидролазам, отщепляет два аминокислотных фрагмента Гис–Лей. На блокировке этого избирательного фермента основано действие современных средств для лечения гипертонии – энапа (эналаприла), каптоприла (капотена) и др. Такой путь образования гормонов пептидной природы позволяет ЦНС быстро и эффективно регулировать их содержание в крови. Аналогично поддерживается уровень такого важного пептидного гормона, как инсулин (см. стр. 182). Еще один пример представлен образованием тетрапептида, стимулирующего высшую нервную деятельность, из адренокортикотропного гормона (АКТГ). Аминокислотная последовательность этого секретируемого гипофизом гормона, состоящего из 39 аминокислот, включает последовательность Мет–Глу–Гис–Фен (от четвертой до седьмой аминокислоты с N‑конца). Соответствующий этой последовательности тетрапептид в незначительном количестве образуется при протеолизе АКТГ. На его основе получено одно из немногих лекарств пептидной природы с широким спектром действия – семакс (Мет–Глу–Гис–Фен–Про–Гли–Про). Принцип последовательного соединения аминокислот в белковые молекулы, включающие чаще всего несколько сотен аминокислот, при катализе избирательными ферментами на каждой стадии невозможен, поскольку число таких ферментов превысит все разумные пределы. Это тем более очевидно, что последовательность аминокислот в белке закодирована в молекуле мРНК, согласование кодонов которой с активными центрами каждого из таких ферментов привело бы к еще большему усложнению задачи. Вот почему для синтеза белков живая природа использует уникальный механизм, реализуемый в рибосомах, состоящих из двух субъединиц, каждая из которых включает несколько десятков белков и одну или две молекулы РНК (так называемые рибосомальные РНК, рРНК); на долю рРНК в рибосомах приходится около 65% их общей массы. Для узнавания аминокислоты комплексом рибосомы и мРНК служат транспортные РНК (тРНК), к которым избирательные ферменты присоединяют соответствующие белковые аминокислоты. Каждая молекула тРНК состоит из примерно 80 нуклеотидов, многие из которых модифицированы (чаще всего они метилированы). Спаренные основания в молекулах тРНК образуют четыре коротких спирали, три из которых заканчиваются петлями. Если молекулу тРНК расположить в плоскости, то она будет иметь форму клеверного листа, который, правда, больше похож на крест. Начало и конец линейной молекулы тРНК образуют спираль, которой противостоит спираль с петлей, включающей антикодон, предназначенный для связывания с кодоном мРНК. Концевой участок тРНК (чаще всего он состоит из четырех нуклеотидов, где три последних это –ССА) не вовлечен в образование водородных связей с начальным участком тРНК, это так называемый 3¢‑конец. Синтез белка начинается с того, что карбоксильная группа аминокислоты ацилирует гидроксильную группы в рибозидном фрагменте тРНК с 3¢‑конца соответствующей этой аминокислоте тРНК. Активация карбоксильной группы идет по обычному механизму с участием АТФ, превращающегося при этом в АМФ и пирофосфат. Поскольку пирофосфат разлагается пирофосфатазой на две молекулы фосфата, этот процесс эквивалентен расходованию двух молей АТФ. Катализ этой реакции осуществляют аминоацил-тРНК-синтетазы, специфичные по каждой аминокислоте и по каждой соответствующей ей тРНК (для некоторых аминокислот может быть несколько тРНК). После образования аминоацилзамещенной тРНК аминокислота больше не участвует в распознавании, то есть каталитический центр рибосом, предназначенный для образования пептидных связей, неизбирателен, он универсален для всех связанных с соответствующими тРНК аминоацильных остатков. Организующая поверхность (мРНК) и аминоацилзамещенные тРНК встречаются на рибосомах, где и идет сборка полипептидной цепи. В клетках животных основная масса рибосом связана с эндоплазматическим ретикулумом («шероховатый» ретикулум). В синтезе белка выделяют три стадии – инициация, элонгация и терминация. Синтез белковой молекулы начинается с инициирующей тРНК, связанной с N‑формилметионином в прокариотических клетках и с метионином в эукариотических клетках. Это означает, что в эукариотических клетках кроме тРНКMet, предназначенной для введения в состав белка молекулы метионина в процессе элонгации, есть еще одна тРНКMet, принимающая участие в инициации синтеза белка. На большой и на малой субъединицах рибосомы есть два центра связывания, обозначаемые буквами Р и А: пептидилсвязывающий центр (Р) и аминоацилсвязывающий центр (А). Для образования синтезирующего белок комплекса от рибосомы отходит малая субъединица и связывается с мРНК. Затем к комплексу мРНК и малой субъединицы рибосомы присоединяется инициирующая метионил–тРНКMet (напомним, что у прокариот это формилметионил–тРНКfMet), то есть специфичность связывания определяется антикодоном на метионил–тРНКMet и соответствием этой инициирующей аминоацилированной тРНК пептидилсвязывающему центру. После этого с участием гуанозинтрифосфата, разлагающегося при этом на гуанозиндифосфат и фосфат, происходит присоединение большой субъединицы рибосомы к комплексу, состоящему из малой субъединицы рибосомы, мРНК и инициирующей метионил–тРНКMet. В этом сложном процессе принимают участие белковые факторы инициации (IF, IF2 и IF3). Далее идет процесс элонгации, когда к аминоацилсвязывающему центру в соответствии с кодоном на мРНК подходит другая соответствующая ему тРНК, несущая аминоацильный остаток. В этом снова участвуют вспомогательные белки, называемые факторами элонгации, а энергию для связывания снова поставляет ГТФ. В состав рибосомы входит фермент пептидилтрансфераза, в активном центре которой оказываются ацилированные аминокислотами 3¢‑концы инициирующей метионил–тРНКMet и второй тРНК. При катализе этим ферментом метионильный остаток ацилирует аминогруппу связанной с тРНК аминокислоты, в результате чего в пептидилсвязывающем центре оказывается тРНКMet со свободными гидроксильными группами в 2¢- и 3¢-положении, а в аминоацилсвязывающем центре тРНК с дипептидильным остатком, например:
Свободная инициирующая тРНКMet покидает пептидилсвязывающий центр, и происходит одновременное смещение мРНК и тРНК с дипептидильным остатком в освободившийся пептидилсвязывающий центр. Энергию для этого снова поставляет ГТФ. В освободившемся аминоацилсвязывающем центре оказывается третий кодон мРНК, после этого сюда подходит третья мРНК с соответствующей аминокислотой, и процесс повторяется уже с переносом на аминоацильный остаток дипептидильного остатка. Так наращивание последовательности аминокислот в белке идет до тех пор, пока в аминоацилсвязывающий центр перемещаются соответствующие кодоны мРНК. После окончания синтеза белковой молекулы к работе рибосомы подключаются факторы терминации, вызывающие гидролитическое отщепление белка (полипептида) от последней тРНК, отделение от пептидилсвязывающего центра свободной тРНК и диссоциацию рибосомы на малую и большую субъединицы для того, чтобы можно было начать новый цикл синтеза белка со стадии инициации. Энергетическая стоимость образования одной пептидной связи на рибосоме эквивалентна расходованию четырех молекул АТФ, что значительно выше, чем при ферментативном катализе образования пептидной связи без участия РНК. Напоминаем, что при образовании аминоацилированной тРНК АТФ разлагается на АМФ и два моля фосфата, а при элонгации расходуется еще два моля ГТФ на связывание аминоацилированной тРНК и на перемещение ее из аминоацилсвязывающего центра в пептидилсвязывающий центр. Для наработки большого количества белка на одной молекуле мРНК могут одновременно вести его синтез несколько рибосом. По мере элонгации молекулы белка идет его сворачивание в трехмерную структуру (фолдинг), но синтез молекулы начинался с метионина или, соответственно, формилметионина и далеко не все белки или полипептиды имеют его в качестве N‑концевой аминокислоты. Это означает, что после отделения от рибосомы полипептидной молекулы должен пройти гидролиз на ее N-конце с отщеплением остатка метионина (обычно отщепление затрагивает несколько аминокислотных остатков). Кроме того, синтезированные в клетке белки часто должны пройти через клеточные мембраны для того, чтобы проникнуть в какие-либо клеточные органеллы или выйти из клетки. Для этого синтезируемый рибосомой белок содержит в N‑концевой области полипептидную последовательность из 15–30 аминокислот с гидрофобными радикалами, ее называют сигнальной последовательностью. Она «протаскивает» белковую молекулу через соответствующую мембрану и после этого также отщепляется. Постсинтетическое превращение белка, включающее иногда и химическое превращение в боковых цепях аминокислот в составе полипептидной цепи, называют процессингом, он включает также повторный фолдинг трасформированной белковой молекулы. Синтез белка нарушается многими биологически активными веществами синтетического или природного происхождения. В качестве примера можно привести антибиотик хлорамфеникол
подавляющий синтез белка рибосомами прокариот и митохондрий, но не влияющий на работу внемитохондриальных рибосом эукариот. Еще один антибиотик пуромицин
имитирует 3¢-конец фенилаланиновой или тирозиновой тРНК с соответствующей аминокислотой; его действие основано на конкурентом встраивании в активный центр пептидилтрансферазы рибосомы, где он ацилируется уже образовавшимся пептидильным остатком на тРНК. Это приводит к образованию укороченных пептидных молекул с пуромициновым фрагментом на С-конце. Образование азотистых оснований и нуклеиновых кислот В разделе, посвященном нуклеиновым кислотам (см. стр. 57–58), были представлены некоторые антиметаболиты, нарушающие их биосинтез из-за подобия их структур структурам естественных исходных продуктов. Здесь будут рассмотрены отдельные биохимические процессы, которые проясняют механизмы действия этих БАВ. Животные, получающие нуклеиновые кислоты с пищей, менее чувствительны к блокировке их образования, что позволяет синтезировать вещества, которые будут избирательно действовать на растения и на микроорганизмы. Биосинтез пуриновых оснований начинается с 5-фосфорибозы, которая превращается в 5-фосфорибозил-1-пирофосфат в реакции с АТФ. Если в организм поступает достаточное количество ДНК и РНК, гидролизующихся соответствующими ферментами (в том числе и до азотистых оснований), то активированная форма рибозы по схеме, представленной в гл. 3, взаимодействует с азотистыми основаниями с образованием соответствующих нуклеотидов и пирофосфата (реутилизация пуриновых оснований). Если же пуриновые основания должны образоваться в клетке, то их биосинтез начинается с 5-фосфорибозил-1-пирофосфата, превращающегося в реакции с глютамином в 5-фосфорибозиламин:
|
||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 97; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.191.169 (0.072 с.) |