
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Возникновение кристаллических зародышей
В концентрированных растворах все элементарные процессы, сопровождающие кристаллизацию, протекают с такой высокой скоростью, что можно говорить, как показал И.В.Мелихов, о феномене концентрационного влияния среды на кристаллизацию как проявлении кооперативного взаимодействия молекул кристаллизующегося вещества (кристаллизанта) в растворе. При этом кооперативность взаимодействия оказывается существенной на всех стадиях кристаллизации, а именно при зарождении и росте кристаллов, при агломерации и созревании кристаллизующейся фазы. Кооперативность взаимодействия проявляется в том, что перешедшие из раствора в кристаллы молекулы кристаллизанта, увеличивая площадь поверхности кристаллов, способствуют переходу последующих молекул; и так до тех пор, пока в растворе не исчезнет вещество, способное перейти в кристаллы. Увеличение площади поверхности преобладает на первом, а исчезновение вещества - на втором этапе кристаллизации. Это показывает соотношение
где М∞ = (С 0- С ∞) V 0 - масса вещества, способного перейти в кристаллы при исходной концентрации кристаллизанта в растворе С 0 и объеме системы V 0; С ∞ - растворимость кристаллизанта; a, t 0 и γ – параметры кристаллизации. Соотношение (24.5) описывает большинство опытных данных о кристаллизации веществ разной природы при значениях a, t 0 и γ, зависящих от С 0 и температуры раствора Т, но остающихся постоянными в процессе кристаллизации. Согласно формуле (24.5), кристаллизация в закрытой системе проходит через периоды возрастания и падения скорости процесса:
причем характеристической величиной является максимальное значение скорости W. Связь скорости процесса с концентрацией раствора можно характеризовать параметром, который отражает течение всех элементарных процессов,
где WM – максимальное значение скорости W. Образование кластеров молекул растворенного вещества. В растворе любой концентрации часть молекул кристаллизанта образует группы, в которых молекулы входят в ближайшие координационные сферы друг друга. У некоторых из таких групп молекулы не прерывают контакта друг с другом в течение периода τ с, значительно превышающего период τ 0 между их трансляционными движениями. Группу, в которой все молекулы удовлетворяют условию τ с >> τ 0, можно рассматривать как кластер, перемещающийся как единое целое. Время жизни такого кластера равно минимальному из значений τ с у составляющих его молекул. В разбавленных растворах таких кластеров может быть мало. В концентрированных средах они присутствуют в заметных количествах.
Вероятность образования кластеров в объеме раствора иная, чем вблизи поверхности стенок кристаллизатора, или вблизи твердых тел, введенных в раствор. Как правило, твердые тела способствуют образованию кластеров, на что указывает множество косвенных данных. Установлено, что концентрация крупных кластеров, сформированных преимущественно в объеме раствора, возрастает в пределах диффузионного слоя по мере удаления от кристалла, что свидетельствует об их встраивании в кристалл. При миграции кластера состояние его молекул непрерывно изменяется вследствие вариации межмолекулярных расстояний и параметров взаимной их ориентации. Возможны также скачкообразные изменения конфигурации кластера (реконструкция кластера). В реконструкцию почти одновременно вовлекаются все молекулы кластера. Поэтому при описании кластерообразования каждый кластер следует характеризовать рядом { у i } параметров состояния, включающих массу и скорость движения кластера как целого, пространственные координаты каждой молекулы относительно центра массы, частотами и амплитудами колебательных движений, частотами и направлениями трансляционных перемещений каждого атома и т. д. Коллектив кластеров, содержащих одинаковое число п молекул, характеризует функция распределения кластеров по { у i }:
где р n - число параметров состояния, вовлеченных в рассмотрение; Nn - число кластеров с данным п, у которых параметры состояния не превышают {у i }, в единице объема раствора. Кластерообразование в целом характеризуется множеством функций { fn,(yi, t)}. В процессе кристаллизации параметры состояния кластеров изменяются направленно и случайным образом, так что
где gnj – скорость направленного изменения yi (величина gnj зависит от условий кристаллизации); ξ ni (t) - случайная функция времени. В разбавленных растворах образуется мало кластеров в основном с небольшим числом молекул n, причем кластеры укрупняются путем присоединения отдельных молекул, потому что столкновения кластеров друг с другом маловероятны. А кластеры малы, то распадаются они также с преимущественным отделением одной молекулы. Имитация образования кластеров в концентрированных растворах осуществлена в суспензиях из стеклянных шаров (занимающих 30 % объема суспензии) в водно-глицериновой среде.
Образование зародышей кристаллов. Зародышем кристалла является кластер, который в процессе кристаллизации гарантированно разовьется в крупный кристалл. Так как развитие кластеров происходит на фоне действия случайных факторов, что отражают функции ξ ni (t), то не каждый кластер может превратиться в кристаллы, но удается это не каждому из них.
Число кластеров в единице объема раствора равно:
где интегрирование ведется по всем { у i } от { у in } до предельных значений { yim }, не противоречащих законам сохранения; пт - максимальное число молекул в кластерах, способных влиять на кристаллизацию. Частота появления зародышей (скорость нуклеации) равна где Кластеры молекул распадаются, если их растворимость оказывается выше концентрации раствора. Между r кр и степенью пересыщения раствора с / с 0 существует зависимость, которая приближенно выражается уравнением
где с – массовая концентрация вещества в пересыщенном растворе в момент начала кристаллизации, кг/м3; с 0– растворимость вещества, кг/м3; σ – удельная поверхностная энергия на границе раздела фаз, Н/м; М – мольная масса; R – газовая постоянная; Т – абсолютная температура раствора, К; r т – плотность твердой фазы, кг/м3; r кр – критический размер зародыша, м.
Из приведенного уравнения следует, что мелкие частицы обладают более высокой растворимостью, чем крупные. Это свойство используется для объяснения причин рекристаллизации осадков. Исходя из посылок термодинамической теории кристаллообразования, Гиббс получил оценку критического зародыша в виде
где D μ = RT lnα – разность химических потенциалов жидкой и кристаллической фаз (α – коэффициент пересыщения); σ – коэффициент поверхностного натяжения; V – объем, приходящийся на одну молекулу в новой фазе. Уравнение (24.12) получено путем минимизации величины работы образования зародыша, выражение которой содержит две компоненты – изменение свободной энергии (термодинамического потенциала) за счет образования новой фазы и возникновение поверхности раздела. Скорость образования кристаллических зародышей может быть также выражена уравнением
где Е – минимальная энергия, необходимая для возникновения зародыша, равная одной трети работы образования его поверхности
Увеличению скорости кристаллообразования J способствуют перемешивание, ультразвук, высоковольтный разряд, присутствие кристаллов растворенного вещества, нерастворимых примесей.
|
|||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 79; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.107.241 (0.009 с.) |
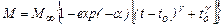 , (24.5)
, (24.5)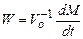 , (24.6)
, (24.6)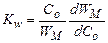 , (24.7)
, (24.7)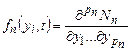 ,
,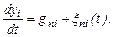 (24.8)
(24.8) После затухания конвекции, вызванной приготовлением суспензии, в последней наблюдалось синхронное движение групп из 102…103 шаров, между которыми видна четкая граница (рис. 24.2). В этом случае суспензия представляла собой совокупность кластеров, в каждом из которых шары имели сходное направление движения. Таким образом, в концентрированных растворах создаются условия для образования крупных кластеров. На рис. 24.2 видно, что «гидродинамические» кластеры разделены границами толщиной порядка размера частиц. Данный факт указывает на то, что при увеличении размера кластера пограничные частицы соседних кластеров скачкообразно изменяют направление движения, пристраиваясь к частицам данного кластера.
После затухания конвекции, вызванной приготовлением суспензии, в последней наблюдалось синхронное движение групп из 102…103 шаров, между которыми видна четкая граница (рис. 24.2). В этом случае суспензия представляла собой совокупность кластеров, в каждом из которых шары имели сходное направление движения. Таким образом, в концентрированных растворах создаются условия для образования крупных кластеров. На рис. 24.2 видно, что «гидродинамические» кластеры разделены границами толщиной порядка размера частиц. Данный факт указывает на то, что при увеличении размера кластера пограничные частицы соседних кластеров скачкообразно изменяют направление движения, пристраиваясь к частицам данного кластера. Установлено, что если в концентрированной суспензии твердых сферических частиц размером d = 10…50 мкм в жидкой среде увеличивать долю объема, приходящегося на частицы, то в суспензии появляются участки, в которых частицы располагаются упорядоченно (рис. 24.3). Участки – это кластеры частиц, объединенных по признаку упорядоченного пространственного расположения в виде объемноцентрированной или гранецентрированной укладки.
Установлено, что если в концентрированной суспензии твердых сферических частиц размером d = 10…50 мкм в жидкой среде увеличивать долю объема, приходящегося на частицы, то в суспензии появляются участки, в которых частицы располагаются упорядоченно (рис. 24.3). Участки – это кластеры частиц, объединенных по признаку упорядоченного пространственного расположения в виде объемноцентрированной или гранецентрированной укладки.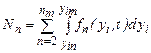 , (24.9)
, (24.9)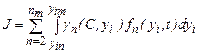 , (24.10)
, (24.10) - вероятность того, что кластер с параметрами состояния { у i } в единицу времени изменит состояние до такого, при котором он гарантированно превратится в кристалл.
- вероятность того, что кластер с параметрами состояния { у i } в единицу времени изменит состояние до такого, при котором он гарантированно превратится в кристалл.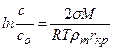 , (24.11)
, (24.11)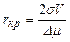 , (24.12)
, (24.12)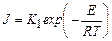 , (24.13)
, (24.13)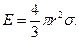 (24.14)
(24.14)


