
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Представления о массовой кристаллизацииСтр 1 из 6Следующая ⇒
Методы кристаллизации
Кристаллизация охлаждением может быть осуществлена: – путем прямого или косвенного теплообмена между горячим раствором, содержащим кристаллизуемое вещество, и более холодной средой (газом, например, воздухом или аммиаком и жидкостью, например, водой или рассолом); – испарением при пониженном давлении и постоянной температуре, называемым обычно вакуум-охлаждением. Если в качестве охлаждающей среды используется холодный воздух, находящийся в непосредственном соприкосновении с раствором, происходит испарение части растворителя. Однако, как правило, количество выделяющегося кристаллического осадка при прямом охлаждении больше количества, образующегося только вследствие испарения. Поэтому воздушное охлаждение по способу создания пересыщения можно сравнивать с вакуум-охлаждением. Кристаллизация охлаждением обычно применяется для веществ, растворимость которых резко уменьшается с понижением температуры. По мере охлаждения раствора он постепенно становится все более пересыщенным, пока не достигнет нестабильного или метастабильного состояния. После этого из него спонтанно осаждается твердая фаза либо в виде большого количества зародышей, либо на затравочных кристаллах (если они присутствуют в достаточном количестве), ускоряя их рост. Может быть достигнуто состояние, при котором образование зародышей и кристаллизация на затравке протекают одновременно. Эти процессы продолжаются по мере охлаждения раствора до конечной температуры. Однако и по достижении этой температуры раствор еще содержит некоторое остаточное пересыщение, которое может быть относительно небольшим или очень высоким, но значение его в любом случае слишком мало, чтобы поддерживать дальнейшее образование зародышей или их рост. В зависимости от окружающей среды остаточное пересыщение снимается за время от нескольких секунд до нескольких месяцев. Поскольку в растворе сохраняется некоторое остаточное пересыщение, выход продукта при кристаллизации охлаждением иногда может быть меньше выхода, рассчитанного по кривым растворимости, при условии, что не происходит испарения. В практических условиях всегда возможно испарение охлаждаемого раствора вследствие соприкосновения с воздухом. К тому же часть межкристального раствора остается на поверхности кристаллов после фильтрации, поэтому в качестве действительного выхода следует принимать выход, определяемый анализом данных по растворимости.
Наилучшими конструкциями являются кристаллизаторы непрерывного действия с использованием различных способов перемешивания, контроля за образованием зародышей и их ростом, позволяющие получать однородный продукт. Промежуточным типом аппаратов являются кристаллизаторы с воздушным или водяным охлаждением и с перемешиванием. В них получают мелкие, но удовлетворительного качества кристаллы. Кристаллизаторы, в которых в качестве охлаждающей среды используется воздух, и некоторые из так называемых вымораживающих кристаллизаторов отличаются простотой конструкции и отсутствием теплопередающих поверхностей. Кристаллизаторы с водяным охлаждением или с охлаждением при помощи рассола также обладают простой конструкцией, однако применение их ограниченно. Однако понижение температуры часто приводит к значительному увеличению вязкости раствора и замедлению скорости роста кристаллов, поэтому для получения кристаллов заданного размера необходимо увеличивать габариты аппарата. Кроме того, с увеличением вязкости уменьшается скорость теплопередачи через теплопередающую поверхность, что вызывает необходимость увеличения ее размера. Чем выше вязкость межкристального раствора, тем он труднее удаляется при разделении суспензии на центрифугах или фильтрах. В результате получают более влажные кристаллы, загрязненные растворимыми примесями, содержащимися в межкристальном растворе, одновременно возрастает стоимость сушки. Если кристаллы после их отделения промывают от межкристального раствора, то промывную жидкость следует охладить, чтобы избежать дополнительного растворения. Кроме того, для удаления вязкого раствора требуется значительное количество промывной жидкости. Наиболее важная проблема конструирования и эксплуатации охладительного кристаллизатора состоит в том, что наибольшее пересыщение создается около охлаждающей поверхности, поэтому на ней и будут образовываться кристаллы, количество которых может быстро увеличиваться. При этом отдельные части аппарата покроются толстым слоем инкрустаций, что в конечном счете приведет к уменьшению производительности кристаллизатора.
В барабанных и лотковых кристаллизаторах имеются скребковые механизмы, снимающие отложения соли на стенках. Поскольку между скребком и корпусом аппарата создается небольшой зазор, на стенках обычно сохраняется тонкий, но обладающий большим термическим сопротивлением слой осадка. Тщательный контроль рабочих условий с целью уменьшения температурных колебаний до минимума, использование хорошо отполированных трубок или теплопередающих поверхностей, высокие скорости движения раствора (около 2 м/с)и небольшой температурный перепад между межкристальным раствором и охлаждающей средой – все это способствует уменьшению образования инкрустаций. Хорошо спроектированный охладительный кристаллизатор может работать непрерывно (до образования на теплопередающих поверхностях значительного осадка) в течение 200…300 ч.Предложен ряд технических приемов (например, механическое встряхивание охлаждающих элементов), которые способствуют увеличению продолжительности непрерывной эксплуатации аппарата. Вакуум-кристаллизация. На испарение 1 кг воды расходуется около 2510 кДж теплоты. Поэтому, если горячий насыщенный раствор ввести в аппарат, где поддерживается давление более низкое, чем давление насыщенных паров над раствором, часть растворителя мгновенно испарится, и жидкость охладится до температуры, соответствующей давлению испарения плюс некоторое повышение температуры кипения, определяемое температурной депрессией раствора. Таким образом, насыщенный раствор становится пересыщенным, с одной стороны, вследствие частичного испарения растворителя и, с другой стороны, за счет охлаждения. В обычных вакуум-кристаллизаторах нет подвода теплоты извне, кроме физической теплоты питающего раствора. Однако на практике часто используется какой-либо внешний источник дополнительного тепла, с помощью которого обеспечивается большая гибкость процесса; в некоторых случаях источник тепла применяется как способ разрушения зародышей и контроля за их ростом. К преимуществам вакуум-кристаллизаторов относится отсутствие теплопередающих поверхностей, что позволяет изготавливать стальные аппараты с резиновой или пластмассовой облицовкой или из стеклопластиков и т. д. Наибольшее пересыщение в вакуум-кристаллизаторах приходится на границу раздела жидкость – пар, поэтому именно здесь обычно и образуются кристаллические осадки. Кристаллы, оседающие на стенках аппарата и прочно удерживаемые на них, не вызывают серьезных эксплуатационных неудобств, поскольку при периодической вакуум-кристаллизации они растворяются следующей порцией раствора, а при непрерывной вакуум-кристаллизации они могут периодически удаляться со стенок кристаллизатора во время его остановок. В вакуум-кристаллизаторах непрерывного действия должен быть предусмотрен насос, откачивающий суспензию и осветленные растворы, или же аппарат следует устанавливать на таком уровне, чтобы раствор отбирали в местах с давлением выше атмосферного. Кроме того, в вакуум-кристаллизаторах легче осуществлять контроль и поддерживать стабильные (по температуре и концентрации) условия, чем в кристаллизаторах охладительного типа.
Стабильность параметров является важным фактором непрерывного процесса в тех случаях, когда требуется продукт постоянного качества. Однако в промышленных условиях не всегда удается вводить в аппарат идеально постоянные по количеству и качеству исходные растворы. Поэтому вакуум-кристаллизацию предпочитают охладительной кристаллизации, поскольку нестабильность процесса в этом случае в меньшей степени влияет на инкрустацию аппарата. Одновременно возрастает и продолжительность работы между промывками. Вакуум-кристаллизаторы непригодны для кристаллизантов с высокой температурной депрессией. Кристаллизаторы охладительного типа наиболее целесообразно использовать, если кристаллизующийся раствор содержит большое количество неконденсирующихся газов. Кристаллизация выпариванием. Если к вакуум-кристаллизатору подводить теплоту извне, то такой аппарат становится выпарным кристаллизатором. Выпаривание может производиться не только в вакууме, а и в аппаратах, работающих под атмосферным или избыточным давлением. Подводимая теплота (или большая ее часть) обычно передается раствору через теплопередающую поверхность трубчатого кипятильника, в результате путем выпаривания раствор концентрируется и создается пересыщение. Вещество, обладающие пологими кривыми растворимости, получают выпариванием. Большинство веществ, которые кристаллизуются охлаждением растворов в вакууме, можно более экономично получать в процессе выпаривания в вакууме. Если пар подвергается повторному сжатию, часть его можно возвращать обратно в греющую камеру. Правильный выбор степени сжатия и рабочих условий позволяет приблизить одноступенчатый вакуум-выпарной аппарат по эффективности к обычной двухступенчатой выпарной установке. Как при наличии терморекомпрессии, так и без нее выпарные кристаллизаторы объединяют в многокорпусные установки и уменьшают тем самым эксплуатационные расходы (рис. 24.11).
Соли, осаждающиеся при выпаривании на греющих поверхностях, представляют собой вещества с обратной растворимостью. Это могут быть примеси (например, сульфат кальция) или основное кристаллизуемое вещество (например, безводный сульфат натрия). Такие соли могут кристаллизоваться при выпаривании растворов в аппаратах непрерывного действия без образования накипи, если в процессе упаривания тщательно контролируется пересыщение и перед увариванием в аппарат вводится затравка для инициирования кристаллообразования. При наличии в кристаллизаторах внутренних нагревательных камер возможно, как это указывалось ранее, неравномерное распределение раствора по трубкам, которое возрастает по мере увеличения диаметра аппарата. С увеличением диаметра может возникнуть чрезмерное пересыщение раствора в отдельных трубках, приводящее к их зарастанию. В аппаратах с выносными кипятильниками сечение трубок выбирается с таким расчетом, чтобы скорость раствора в них была примерно 1,8…2,2 м/с,поэтому в кипятильниках трубки обычно монтируются в значительно меньшем количестве, но зато более длинные. Таким образом, распределение раствора и пара в нагревателе становится более равномерным, и условия теплопередачи в отдельных трубках мало отличаются друг от друга. В выносном нагревателе в отличие от аппаратов с внутренней греющей камерой легче контролировать пересыщение. Во всех вакуум-выпарных аппаратах и выпарных кристаллизаторах пересыщение создается в местах образования пузырьков пара, поэтому в большинстве конструкций нагревательные камеры устанавливают таким образом, чтобы избежать кипения в трубках. Пузырьки пара вначале появляются в местах несколько ниже уровня раствора в зависимости от его перегрева. По мере движения пузырьков к поверхности раствора они увеличиваются в объеме, скорость раствора и парожидкостной смеси быстро возрастает к моменту выхода пара в сепарационную часть аппарата. Если скорость парожидкостной смеси слишком высока, брызги раствора могут попадать на стенки или крышку аппарата, способствуя тем самым отложению кристаллических осадков, а также уносу капель жидкости с паром, выходящим из кристаллизатора. Поэтому при проектировании следует предусмотреть возможный перегрев раствора всего лишь на несколько градусов вследствие прохождения его через нагреватель.
Пересыщение увеличивается до тех пор, пока пузырьки пара не покинут поверхности раствора. Если конструкция выпарного аппарата такова, что по его контуру циркулирует смесь раствора и кристаллов, часть кристаллов, находящаяся в контакте с пересыщенным раствором, способствует снятию пересыщения. Если выпарной аппарат представляет собой конструкцию, в которой кристаллы находятся в отдельной зоне и поддерживаются в псевдоожиженном состоянии, то для снятия пересыщения образующийся раствор следует ввести во взвешенный слой кристаллов. Сушка распылением кристаллизуемых веществ также является одним из видов кристаллизации выпариванием, при котором источником тепла для выпаривания и средством для удаления паров растворителя служит сухой горячий воздух. Выпаривание происходит мгновенно, поэтому образующиеся кристаллы имеют небольшой размер (последний, а также форма кристаллов зависят от конфигурации распыляемых капель). Сушка распылением нашла лишь ограниченное применение для кристаллизации растворов, в частности, этим методом получают безводный сульфат натрия. Кристаллизация за счет химической реакции. Если химическая реакция между двумя компонентами протекает в жидкости, в которой растворяется образующееся соединение, то при непрерывном процессе вначале может быть получен насыщенный, а затем и пересыщенный раствор и в конечном счете начнется кристаллизация. Примером такой кристаллизации является получение карбоната кальция в результате реакции ионов Са2+ и Выбрав соответствующую скорость циркуляции и наладив контроль пересыщения, в кристаллизаторе можно поддерживать рабочую температуру около 70 °С; при этом теплота нагревания достаточна для испарения части раствора. Реакционные кристаллизаторы работают при температурах раствора 50…80 °С. Если не учитывать конструкции, обеспечивающие непрерывный подвод реагирующих веществ и воды, реакционный кристаллизатор можно проектировать как выпарной кристаллизатор, т. е. объем циркулирующего раствора или суспензии рассчитывается так, чтобы температура циркулирующей среды повышалась за счет теплоты реакции всего на несколько градусов.
Например, для высаливания кристаллов NH4C1 из отработанных растворов хлористого аммония, полученных в процессе производства кальцинированной соды, применяют NaCl. Также для выделения чистого сульфата алюминия из водных растворов используется этиловый спирт. Эффект высаливания часто приходится учитывать при решении многих вопросов кристаллизации, связанных с выпариванием, т. к. в этом случае концентрация растворимых примесей может повыситься до такой степени, когда примеси уменьшают растворимость основного вещества. Плавление. Если кристаллогидрат нагревать выше точки, соответствующей переходу его в менее гидратированную или безводную форму, то он будет плавиться в кристаллизационной воде с образованием низших кристаллогидратов или безводной соли в насыщенном растворе данного вещества. В практических условиях установка состоит из двух ступеней: плавителя и выпарного аппарата. Для большей экономичности процесса используют выпарку с терморекомпрессией и отводом части пара для плавления кристаллов. Иногда суспензия из плавителя используется в качестве питания выпарного аппарата. В других случаях мелкокристаллический продукт из плавителя собирается отдельно. Фракционная кристаллизация осуществляется при наличии в растворе одновременно нескольких подлежащих извлечению веществ. При этом создаются условия для последовательного осаждения веществ посредством изменения температуры и концентрации раствора. Фракционную кристаллизацию широко применяют в химической, фармацевтической, пищевой и других отраслях промышленности для получения веществ высокой чистоты. С помощью фракционной кристаллизации решаются следующие основные задачи: разделение смесей на фракции, обогащенные тем или иным компонентом; глубокая очистка веществ от примесей; выделение различных веществ из технических и природных растворов; концентрирование разбавленных растворов путем частичного отделения макрокомпонента. Во всех случаях фракционной кристаллизации исходная смесь содержит по крайней мере два компонента, которые в твердом, жидком или газообразном состоянии обладают той или иной взаимной растворимостью. Кристаллизацию из растворов применяют преимущественно при переработке неорганических веществ. Часто добавление растворителя к исходной смеси позволяет повысить эффективность разделения за счет увеличения коэффициентов распределения. В качестве хладагентов используют охлажденные жидкости и газы, сжиженные газы, которые при контакте с кристаллизующейся смесью переходят в газообразное состояние, а также твердые вещества, расплавляющиеся в процессе контактной кристаллизации. К контактной кристаллизации также следует, видимо, отнести процесс фракционной кристаллизации при смешении исходной смеси с сильно переохлажденным растворителем. Рассматриваемому процессу присущ и недостаток, связанный с необходимостью осуществления дополнительной стадии отделения некоторых отработанных хладагентов от кристаллизата, сопряженный с установкой дополнительного оборудования. Контактную кристаллизацию с использованием газообразных хладагентов часто применяют для выделения различных солей из водных растворов. Данный процесс можно успешно использовать и для фракционирования различных органических расплавов. Пересыщение раствора в данном случае достигается частично за счет его охлаждения, а частично в результате испарения некоторого количества растворителя. В качестве хладагента чаще используют охлажденный воздух, реже – инертные газы (например, азот). При контактной кристаллизации с газообразным хладагентом практически исключено загрязнение хладагентом продуктов разделения. Процесс, как правило, легко регулируется и быстро выходит на стационарный режим. Недостаток процесса – большой расход газа из-за низкой его теплоемкости. Метод кристаллизации при непосредственном контакте разделяемой смеси с хладагентом имеет следующие преимущества (по сравнению с массовой кристаллизацией с отводом тепла через теплопередающие поверхности): – высокая интенсивность тепло- и массообмена, обусловленная развитой межфазной поверхностью и интенсивным перемешиванием; – возможность кристаллизации при незначительной разности температур между кристаллизующейся смесью и хладагентом (порядка 0,5…2,0 °С); – отсутствие в кристаллизаторах теплообменных поверхностей, что исключает их инкрустацию и существенно упрощает конструкцию аппаратов; – возможность изготовления аппаратов из конструкционных материалов с низкой теплопроводностью (полимеры, стекло, керамика и т. д.), а также их защиты различными антикоррозионными покрытиями (эмаль, резина, лаки, полимерные и другие мастики). Для контактной кристаллизации с газообразным хладагентом наиболее часто применяют кристаллизаторы барботажного типа. Большинство из них представляет собой вертикальные цилиндрические аппараты, в нижней части которых расположено одно или несколько газораспределительных устройств (барбо-теров) в виде газораспределительных насадок, коллекторов, набора сопел и т. п. В таких аппаратах для интенсификации перемешивания кристаллизующейся смеси часто устанавливают внутренние циркуляционные трубы.
РАСЧЕТ КРИСТАЛЛИЗАТОРОВ Материальный баланс кристаллизации. Основой для определения размеров кристаллизатора и оценки кристаллизации как части производственного процесса являются материальные и тепловые балансы. Поэтому правильному составлению материальных и тепловых балансов необходимо уделять большое внимание. Для расчета материальных потоков, участвующих в процессе кристаллизации, составляют материальный баланс по общей массе вещества G р = G м + G кр + W (24.21) и баланс по абсолютно сухому растворенному веществу G р х р = G м х м + G кр a, (24.22) где G р, G м и G кр - расход соответственно исходного и межкристального растворов и полученных кристаллов, кг/с (для периодического процесса принимаются соответствующие количества компонентов, кг); W - расход выпаренного растворителя, кг/с (масса удаленного растворителя, кг); х ри х м - концентрация растворенного вещества в исходном и межкристальном растворах, массовые доли; a = M / M кр - отношение молекулярных масс абсолютно сухого растворенного вещества и кристаллосольвата (для водного раствора кристаллогидрата); при кристаллизации без присоединения молекул растворителя M = M кр и a = 1. Решая уравнения (24.21) и (24.22), определяют количество полученных кристаллов
Если кристаллизация осуществляется путем охлаждения, то W = 0, и уравнение (24.23) принимает вид
При изотермическом испарении (если подают насыщенный раствор) х р= х м, и уравнение (24.23) преобразуется в соотношение
При адиабатическом испарении уравнение (24.23) необходимо решать совместно с уравнением теплового баланса. Тогда
где с кр, с 1 и с 2 - удельная теплоемкость соответственно кристаллов, исходного и межкристального растворов, Дж/(кг·К); r и q кр - теплота испарения и кристаллизации, Дж/кг; t 1и t 2- температура исходного и межкристального растворов, °С. Расход газообразного хладагента на процесс контактной кристаллизации можно рассчитать по уравнению
где I 1 и I 2 – энтальпия исходного и отработанного хладагента, отнесенные к 1 кг его абсолютно сухой части (I 1 и I 2 определяются температурой и влагосодержанием потока Gx; они могут быть определены по I – d диаграмме влажного воздуха). Количество испаренного растворителя W, уносимого потоком газообразного хладагента, составляет W = Gx (d 2 – d 1), (24.28) где d 1 и d 2 – абсолютная влажность хладагента на входе в кристаллизатор и на выходе из него (d 1 определяется исходным состоянием хладагента: температурой θ 0 и его относительной влажностью φ 0; d 2 в первом приближении можно определить в предположении, что отработанный хладагент нагревается до температуры θ 2 = t ф и имеет относительную влажность φ 2 = 1). При испарении растворителя в газ (воздух) расход сухого газа L,кг, определяется из уравнения
где L - расход сухого газа (воздуха), кг; х 1, х 2- начальное и конечное влагосодержание газа (воздуха), кг влаги/кг сухого газа. На основе материальных балансов получены также уравнения, позволяющие рассчитать соотношение компонентов при приготовлении растворов заданной концентрации с (% масс.). Масса растворяемого твердого вещества
где G 1 – масса получаемого раствора, кг. Необходимая масса растворителя составляет
Если раствор выпаривается от концентрации x н до c, то масса испаряемого растворителя определяется из уравнения
При разбавлении растворителем применяется аналогичная формула
Тепловой баланс кристаллизации. При растворении кристаллов происходит поглощение теплоты q кр для разрушения кристаллической решетки (теплота плавления) и выделение теплоты при химическом взаимодействии вещества с растворителем qp (образование гидратов). В зависимости от значений q к p и qp тепловой эффект кристаллизации может быть положительным или отрицательным. Используем следующие обозначения: i р, i кр, i м - энтальпия раствора кристаллов и межкристального раствора, кДж/кг; i т1, i т2 - начальная и конечная энтальпия теплоносителя, кДж/кг; i о1, i о2 - начальная и конечная энтальпия охлаждающей среды, кДж/кг; I – энтальпия парообразного растворителя (вторичного пара), кДж/кг; r - теплота образования кристаллической решетки (теплота затвердевания), кДж/(кгкристаллов); D q – тепловой эффект концентрирования раствора при изменении его концентрации от х ндо х м, кДж/кг; G T, G 0 - массовое количество теплоносителя или охлаждающей среды, кг/ с. Тепловой баланс кристаллизатора по приходу и расходу теплоты в общем виде можно выразить следующим образом: Q 1 + Q 2 + Q 3 + Q 4 = Q 5 + Q 6 + Q 7 + Q 8 ± Q 9. (24.34) Приход теплоты складывается из физической теплоты поступающего раствора Q 1 = G р i р, (24.35) теплоты кристаллизации Q 2 = G кр r, (24.36) теплоты дегидратации Q 3 = ±D qG м x м (24.37) и теплоты, поступающей от внешних источников, Q 4 = G т(i т1 – i т2). (24.38) Расход теплоты определяется как сумма теплоты, отводимой с межкристальным раствором, Q 5 = G м i м, (24.39) теплоты, отводимой с кристаллами, Q 6 = G кр i кр, (24.40) теплоты, отводимой с вторичным паром, Q 7 = WI, (24.41) теплоты, отнятой при охлаждении водой, Q 8 = G о(i о2 – i о1), (24.42) а также тепловых потерь в окружающую среду Q 9, которые в зависимости от температурных условий могут быть положительными или отрицательными. В некоторых частных случаях кристаллизации отдельные члены уравнения (24.34) опускаются. Например, при выпарной кристаллизации Q 8 = 0, при кристаллизации охлаждением Q 4 = 0 и Q 7 = 0, при адиабатической вакуум-кристаллизации Q 4 = 0 и Q 8 = 0. Для теплоносителя – насыщенного водяного пара, кДж/с, Q 4 = D (I D – i конд), (24.43) где I D, i конд – энтальпия пара и конденсата, кДж/кг; D – расход пара, кг/с. Для охлаждающей среды – воздуха, кДж/с, Q 8 = L (I 2 – I 1), (24.44) где L – расход сухого воздуха, кг/с; I 1, I 2 – его начальная и конечная энтальпии, кДж/кг. Энтальпии i р, i кр, i м рассчитывают, кДж/кг,по уравнению общего вида i = c (t 2 – t 1), (24.45) где с - средняя удельная теплоемкость, кДж/(кг×К);(t 2– t 1) – перепад температур (конечной и начальной), К. Далее рассматривается определение некоторых величин, необходимых для проведения расчетов по уравнению теплового баланса. Теплоемкость. При отсутствии справочных данных теплоемкость раствора с допустимой погрешностью можно вычислить по формуле, основанной на предположении об аддитивности теплоемкостей,
где с i - удельная теплоемкость i -го компонента раствора, определяемая из справочных таблиц или вычисленная через атомные теплоемкости с ат входящих в него элементов,
Теплота кристаллизации. Так как экспериментальное определение теплоты образования кристаллической решетки (теплоты затвердевания) q крсвязано с существенными трудностями, ее обычно выражают через теплоты растворения и разбавления, измеряемые более простыми методами. По абсолютному значению теплота кристаллизации равна так называемой остаточной дифференциальной теплоте растворения, но обратна ей по знаку. В свою очередь, последняя представляет собой разницу между теплотой растворения 1 моля вещества при бесконечном разбавлении и теплотой разбавления насыщенного раствора, содержащего 1 моль вещества, в бесконечно большом количестве растворителя. Теплота разбавления обычно незначительна по сравнению с теплотой растворения, поэтому в большинстве случаев теплоту кристаллизации можно принимать равной (но с обратным знаком) теплоте растворения, значения которой приводятся в справочных таблицах. Возможна также ориентировочная оценка теплоты кристаллизации по данным кривой растворимости на основе термодинамического уравнения (24.1). Теплота испарения. При расчетах процесса выпаривания необходимо знать теплоту испарения растворителя из концентрированных растворов. Если теплота разбавления сравнительно невелика, то с малой погрешностью можно принять теплоту парообразования раствора r приблизительно равной теплоте испарения чистого растворителя r 0. Если же теплота разбавления велика, то указанное равенство становится уже весьма приближенным и для расчета теплоты испарения лучше пользоваться формулой
где Т и Т0 – температура кипения соответственно раствора и чистого растворителя при давлении р = р 0; Зависимость теплоты испарения от температуры можно рассчитывать по формуле где Т к – критическая температура растворителя. Термохимические расчеты значительно облегчаются при использовании энтальпийных диаграмм, предложенных Я. Нывлтом (рис. 24.22), на которых энтальпия i наносится в зависимости от состава (чаще всего в массовых долях С/100). Кроме определения тепловых величин, энтальпийные диаграммы дают возможность рассчитывать и материальный баланс. Так, например, при кристаллизации охлаждением раствора А 1 его температура понижается от t 0 до t 1. В процессе охлаждения раствор становится насыщенным при температуре t 2(точка R 2), затем из него начинает выделяться твердая фаза. В конечном состоянии состав образовавшейся суспензии отвечает точке В 1 и включает раствор R 1 и кристаллы G кр в массовом соотношении
При кристаллизации за счет уваривания ненасыщенный раствор А 2 сначала нагревают до температуры его кипения t 2 (точка
Энтальпия пара соответствует точке i ', а количество теплоты, переданной раствору, выражается отрезком При вакуум-кристалли-зации раствор R 0, насыщенный при температуре t 0, вводится в кристаллизатор, давление в котором соответствует температуре кипения t 3. За счет испарения воды (энтальпия пара Большинство физико-химических показателей, необходимых для построения энтальпийных диаграмм, приведено в справочных таблицах.
Контрольные вопросы
1. В чем заключается сущность процесса кристаллизации? Каково назначение процес
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 321; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.105.108 (0.103 с.) |
 Теплообменники или трубчатые кипятильники могут быть внутри аппарата или вынесены из него (рис. 24.12). В выпарных кристаллизаторах с внутренней нагревательной камерой обычно не используется естественная циркуляция раствора, для создания принудительной циркуляции они снабжаются различными мешалками. На греющих трубках внутреннего кипятильника отлагается накипь. Они забиваются, главным образом, вследствие небольшой скорости движения в них раствора.
Теплообменники или трубчатые кипятильники могут быть внутри аппарата или вынесены из него (рис. 24.12). В выпарных кристаллизаторах с внутренней нагревательной камерой обычно не используется естественная циркуляция раствора, для создания принудительной циркуляции они снабжаются различными мешалками. На греющих трубках внутреннего кипятильника отлагается накипь. Они забиваются, главным образом, вследствие небольшой скорости движения в них раствора.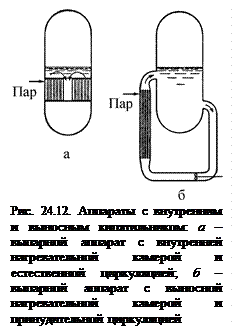 Аппараты с внутренним кипятильником обычно имеют большое количество относительно коротких трубок, которые распределяются на большей части площади поперечного сечения аппарата, в связи с чем трудно добиться одинаковой скорости движения раствора во всех трубках. Так как скорость раствора в трубке обусловливает и скорость теплопередачи, существуют небольшие различия в перегреве раствора, выходящего из отдельных трубок.
Аппараты с внутренним кипятильником обычно имеют большое количество относительно коротких трубок, которые распределяются на большей части площади поперечного сечения аппарата, в связи с чем трудно добиться одинаковой скорости движения раствора во всех трубках. Так как скорость раствора в трубке обусловливает и скорость теплопередачи, существуют небольшие различия в перегреве раствора, выходящего из отдельных трубок.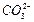 при сатурировании дефекованных сахарсодержащих растворов в аппарате, называемом сатуратор. Разработаны различные конструкции сатураторов, в которых получают кристаллы СаСО3 необходимого качества.
при сатурировании дефекованных сахарсодержащих растворов в аппарате, называемом сатуратор. Разработаны различные конструкции сатураторов, в которых получают кристаллы СаСО3 необходимого качества.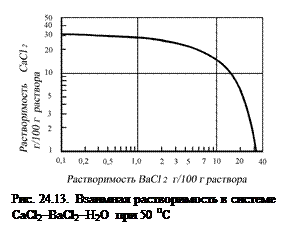 Высаливание. Пересыщение раствора иногда создается в результате добавления в него вещества, уменьшающего растворимость основного компонента. Такой прием называется высаливанием, а иногда – кристаллизацией осаждением или разбавлением. В качестве примера можно привести систему СаСl2-ВаС12-H2O, в которой растворимость ВаС12 существенно понижается при добавлении СаСl2 (на рис. 24.13) взаимная растворимость в системе CaCl2-BaCl2-H2O при 50 °С.
Высаливание. Пересыщение раствора иногда создается в результате добавления в него вещества, уменьшающего растворимость основного компонента. Такой прием называется высаливанием, а иногда – кристаллизацией осаждением или разбавлением. В качестве примера можно привести систему СаСl2-ВаС12-H2O, в которой растворимость ВаС12 существенно понижается при добавлении СаСl2 (на рис. 24.13) взаимная растворимость в системе CaCl2-BaCl2-H2O при 50 °С.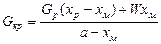 . (24.23)
. (24.23)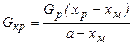 . (24.24)
. (24.24)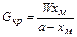 . (24.25)
. (24.25)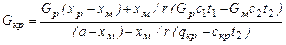 , (24.26)
, (24.26)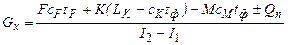 , (24.27)
, (24.27)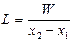 , (24.29)
, (24.29)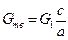 , (24.30)
, (24.30)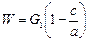 . (24.31)
. (24.31)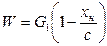 . (24.32)
. (24.32)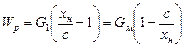 . (24.33)
. (24.33)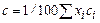 , (24.46)
, (24.46)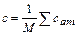 . (24.47)
. (24.47)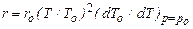 , (24.48)
, (24.48)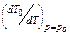 - константа из уравнения Дюринга.
- константа из уравнения Дюринга.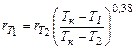 , (24.49)
, (24.49)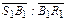 . Если при этом энтальпия охлаждающей воды повышается от i 0 до i 1, то ее количество по отношению к раствору определяется из отношения отрезков
. Если при этом энтальпия охлаждающей воды повышается от i 0 до i 1, то ее количество по отношению к раствору определяется из отношения отрезков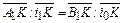 .
.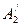 ), и затем испаряют воду. При испарении состояние системы изменяется по изотерме
), и затем испаряют воду. При испарении состояние системы изменяется по изотерме 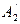 – R 2– В2. В точке R 2 изотерма пересекается с кривой насыщения, и при дальнейшем испарении из раствора выделяются кристаллы.
– R 2– В2. В точке R 2 изотерма пересекается с кривой насыщения, и при дальнейшем испарении из раствора выделяются кристаллы.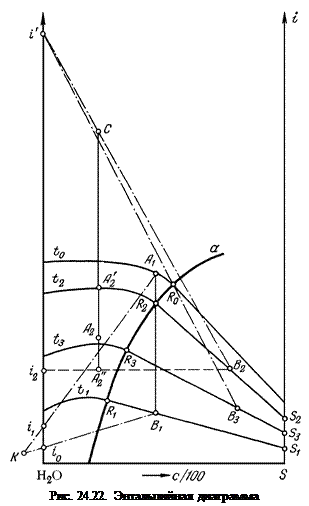 Количество воды, которое необходимо удалить из единицы исходного раствора для достижения конечного состояния В 2, равняется отношению отрезков
Количество воды, которое необходимо удалить из единицы исходного раствора для достижения конечного состояния В 2, равняется отношению отрезков 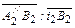 , а соотношение масс твердой и жидкой фазы в полученной суспензии равно
, а соотношение масс твердой и жидкой фазы в полученной суспензии равно 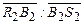 .
.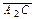 .
.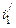 ) раствор охлаждается до этой температуры и одновременно происходит его кристаллизация. Отношение количества кристаллов к количеству маточного раствора в полученной суспензии равно
) раствор охлаждается до этой температуры и одновременно происходит его кристаллизация. Отношение количества кристаллов к количеству маточного раствора в полученной суспензии равно 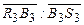 , а отношение количества испаренной воды к количеству суспензии равно
, а отношение количества испаренной воды к количеству суспензии равно 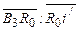 .
.


