
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение энтальпии нейтрализации
Студент получает у преподавателя один из следующих вариантов задания (см. табл.2). Реакционный сосуд после определения постоянной калориметра несколько раз ополаскивают дистиллированной водой и пипеткой вносят в него 25 см3 кислоты, закрывают сосуд пробкой с мешалкой и термометром и производят 10 измерений температуры «предварительного периода» при равномерном перемешивании раствора. Через боковое ответвление реакционного сосуда вносят в него 25 см3 основания. При непрерывном перемешивании раствора производят измерения температуры в «главном» и «заключительном» периодах. Экспериментальные данные записывают в таблицу 1.
Таблица 1
Таблица 2
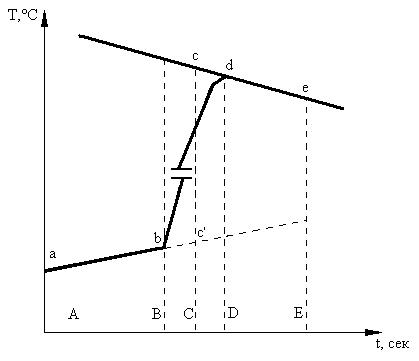
Обработка результатов Рис.1. Зависимость изменения температуры во времени На основании экспериментальных данных (табл.1) вычерчивают на миллиметровой бумаге график изменения температуры во времени (рис.1.). На рисунке АВ - предварительный, BD - главный, DE -заключительный периоды. Для графического определения точного значения ΔT проецируют точки В и D на ось ординат, находят середину отрезка BD и опускают перпендикуляр к оси ординат (сС). Продлевают линейные участки АВ и DE до пересечения с линией сС. Отрезок сс` соответствует изменению температуры ΔТ в калориметрическом опыте с учетом поправки на теплообмен.
Определим значение ΔТ для нитрата калия, вычисляют постоянную калориметра k по уравнению:
Определяют энтальпию нейтрализации (ΔНi) для раствора данной i-той молярной концентрации (сi) по уравнению Δ Hi = k Δ T
Оценивают погрешность (П %) полученного значения энтальпии нейтрализации по отношению к табличному значению:
Результаты вычислений записывают втабл.3 Таблица З
Выводы Исходя из экспериментальных и расчетных значений необходимо оценить силу изученных кислот и оснований, объяснить отклонение полученной экспериментально энтальпии нейтрализации от теоретической. Коллоидная химия Лабораторная работа № 1 Получение коллоидных систем В принципе любые вещества могут быть получены в виде коллоидных систем. При этом различают два основных препаративных метода: конденсацию, при которой молекулы растворенных веществ объединяются в коллоидные частицы, и дисперсию, при которой грубодисперсные материалы раздробляются до коллоидных частиц. Цель работы. Получить коллоидные растворы различных веществ методами конденсации и диспергирования
Конденсационные методы Золь серебра Оборудование. Колбы 500 мл, 100 мл, стакан 800 мл. Реактивы. Раствор 0,2—1 мл 0,1 М нитрата серебра, раствор гидразина гидрата, вода дистиллированная.
К раствору 0,2—1 мл 0,1 М нитрата серебра в 500 см3 воды по каплям прибавляют ~1 см'3 разбавленного раствора гидрата гидразина. Раствор окрашивается в зеленовато-серый цвет и обычно быстро становится мутным. Золь серы Оборудование. Стаканы 50, 100, 200, 600 мл, стеклянный фильтр, ценрифуга, водяная баня, лед, диализатор, пробирки, пипетки лабораторные. Реактивы. Nа2S2О3∙7Н2О, Н2SО4 концентрированная, вода дистиллированная. Раствор, содержащий 50 г Nа2S2О3∙7Н2О в 30 мл Н2О, по каплям добавляют к 70 г конц. Н2SО4, охлаждая кислоту льдом (под тягой!). Выделяется Н20 и SО2 и образуется вязкая реакционная масса, к которой добавляют 30 мл Н2О. Смесь нагревают в течение 10 мин. при 80 °С. Образовавшуюся прозрачную желтую жидкость фильтруют через стеклянный фильтр и оставляют до охлаждения; при этом снова выделяется твердая сера. Остаток, который можно дополнительно очистить центрифугированием, применяют для приготовления золя серы с частицами размером 10-4 см. Для этого разбавляют небольшие количества остатка большим объемом воды и получают прозрачную, очень устойчивую систему. При удалении избытка солей (особенно Nа2SО4) диализом постепенно выделяется сера. Золь А5253 Оборудование. Плитка электрическая, колбы плоскодонные, стаканы, пробирки, пипетки лабораторные
Реактивы. Аs2О3 , Н2S, вода дистиллированная.
Кипятят в воде в течение 0,5 ч тонкоизмельченный порошок Аs2О3 с последующим отфильтровыванием остатка. 20 мл полученного почти насыщенного раствора Н3АsОз разбавляют водой до 100 мл и пропускают (под тягой) через раствор Н2S до насыщения. Образующийся прозрачный желтый коллоидный раствор тонкодисперсного Аs2Sз устойчив при нагревании, но очень чувствителен к присутствию электролитов. При растворении новых порций Аs2О3 в коллоидном растворе и повторном пропускании через него Н2S можно получить золь, содержащий свыше 35% Аз2S3. Дисперсионные методы
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 191; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.22.135 (0.009 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 ,
,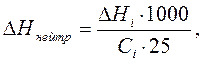 Вычислив энтальпию нейтрализации для данного количества кислоты или основания, рассчитывают интегральную энтальпию нейтрализации ΔHнейтр на один моль кислоты(основания).
Вычислив энтальпию нейтрализации для данного количества кислоты или основания, рассчитывают интегральную энтальпию нейтрализации ΔHнейтр на один моль кислоты(основания).
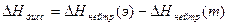 Учитывая, что при образовании 1 моль воды из ионов водорода и гидроксида выделяется 55,9 кДж, по закону Гесса определяют теплоту диссоциации уксусной кислоты или гидроксида аммония.
Учитывая, что при образовании 1 моль воды из ионов водорода и гидроксида выделяется 55,9 кДж, по закону Гесса определяют теплоту диссоциации уксусной кислоты или гидроксида аммония.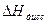 , кДж/моль
, кДж/моль



