
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодическая система элементов⇐ ПредыдущаяСтр 20 из 20
Периоды |
ГРУППЫ ЭЛЕМЕНТОВ | ||||||||||||
| I | II | III | IV | V | VI | VII |
VIII | |||||||
| 1 | H 1 Водород 1,008 | Не 2 Гелий 4,00 | ||||||||||||
| 2 | Li 3 Литий 6,94 | Be 4 Бериллий 9,01 | В 5 Бор 10,81 | С 6 Углерод 12,01 | N 7 Азот 14,1 | О 8 Кислород 16,00 | F 9 Фтор 19,00 | Ne 10 Неон 20,18 | ||||||
| 3 | Na 11 Натрий 22,99 | Mg 12 Магний 24,31 | Al 13 Алюминий 26,98 | Si 14 Кремний 28,09 | Р 15 Фосфор 30,97 | S 16 Сера 32,06 | Cl 17 Хлор 35,45 | Ar 18 Аргон 39,95 | ||||||
| 4 | K 19 Калий 39,10 | Са 20 Кальций 40,08 | 21 Sc Скандий 44,96 | 22 Ti Титан 47,90 | 23 V Ванадий 50,94 | 24 Cr Хром 52.00 | 25 Mn Марганец 54,94 | 26 Fe Железо 55,85 | 27 Со Кобальт 58,93 | 28 Ni Никель 58,70 | ||||
| 29 Cu Медь 63,54 | 30 Zn Цинк 65,37 | Ga 31 Галлий 69,72 | Ge 32 Германий 72.61 | As 33 Мышьяк 74,92 | Se 34 Селен 78,96 | Br 35 Бром 79,90 | Kr 36 Криптон 83,80 | |||||||
| 5 | Rb 37 Рубидий 85,47 | Sr 38 Стронций 87,62 | 39 Y Иттрий 88,90 | 40 Zr Цирконий 91,22 | 41 Nb Ниобий 92,91 | 42 Mo Молибден 95,94 | 43 Тс Технеций 99 | 44 Ru Рутений 101,07 | 45 Rh Родий 1.2,90 | 46 Pd Палладий 106,42 | ||||
| 47 Ag Cеребро 107.9 | 48 Cd Кадмий 112,41 | In 49 Индий 114,82 | Sn 50 Олово 118,71 | Sb 51 Сурьма 121,76 | Te 52 Теллур 127,60 | J 53 Йод 126,90 | Xe 54 Ксенон 131,30 | |||||||
| 6 | CS 55 Цезий 132,9 | Ва 56 Барий 137,33 | 57 * La Лантан 138,90 | 72 Hf Гафний 178,49 | 73 Та Тантал 180,94 | 74 W Вольфрам 183,84 | 75 Re Рений 186,20 | 76 Os Осьмий 190,23 | 77 Ir Иридий 192,22 | 78 Pt Платина 195,08 | ||||
| 79 Au Золото 197,0 | 80 Hg Ртуть 200,59 | Tl 1 Таллий 204,38 | Pb 82 Свинец 207,2 | Bi 83 Висмут 208,98 | Ро 84 Полоний 210 | At 85 Астат 210 | Rn 86 Радон 222,02 | |||||||
| 7 | Fr 87 Франций 223 | Ra 88 Радий 226,03 | 89 ** Ac Актиний 227,03 | 104 Rf Резерфордий 261,11 | 105 Db Дубний 262,11 | 106 Sg Сиборгий 263,12 | 107 Bh Борий 262.12 | 108 Hs Хассий 265 | 109 Mt Мейтнерий 266 | 110 Ds 271 | ||||
| 111 Rg 272 | 112 Uub 285 | Uut 113 284 | Uuq 114 289 | Uup 115 288 | Uuh 116 292 | Uus 117 310? | Uuo 118 314? | |||||||
| *Ланта ноиды | Ce58 Церий 140,12 | Pr 59 Празео- дим 40,9 | Nd 60 Неодим 144,24 | Pm 61 Прометий 145 | Sm 62 Самарий 150,4 | Eu 63 Европий 151,96 | Gd 64 Гадолиний 157,9 | Tb 65 Тербий 58,92 | D у 66 Диспро- зий 162,5 | Но 67 Гольмий 164,93 | Er 68 Эрбий 167,26 | Tm 69 Тулий 168,93 | Yb 70 Иттербий 173,04 | Lu 71 Лютеций 174,97 |
| **Акти ноиды | Th90 Торий 232,04 | Pa 9 1 Протакти- ний 231 | U 92 Уран 38,03 | Np 93 Нептуний 237 | Pu 94 Плутоний 244 | Am 95 Америций 243 | Cm 9 6 Кюрий 247 | Bk 97 Берклий 247 | Cf 98 Калифор- ний 251 | Es 99 Эйнштей- ний 254 | Fm100 Фермий 257 | Md101 Менделе- вий 258 | No102 Нобелий 259 | Lr103 Лоурен- сий 260 |

|
|
ПРИЛОЖЕНИЕ 3
Термодинамические константы веществ
| Вещество | ΔН0298, кДж/моль | S0298, Дж/(моль·К) | ΔG0298, кДж/моль |
| Al(т) | 0 | 28,33 | 0 |
| Al2O3(т) | –1675,69 | 50,92 | –1582,27 |
| Al(OH)3(т) | –1276,1 | 83,8 | –1157,0 |
| ВаО(т) | –553,6 | 70,3 | –528,0 |
| Ва(ОН)2(т) | –946,1 | 103,8 | –886,2 |
| ВаСО3(т) | –1211,0 | 112,1 | –1244,41 |
| С(алмаз) | 0 | 2,4 | 0 |
| C(графит) | 0 | 5,7 | 0 |
| CH4(г) | –74,9 | 186,2 | –50,8 |
| C2H2(г) | 226,8 | 200,8 | 209,2 |
| C2H4(г) | 52,3 | 219,4 | 68,1 |
| C2H6(г) | –89,7 | 229,5 | –32,9 |
| C6H6(ж) | 82,9 | 269,2 | 129,7 |
| C2H5OH(ж) | –277,6 | 160,7 | –174,8 |
| CO(г) | –110,5 | 197,5 | –137,1 |
| CO2(г) | –393,5 | 213,7 | –394,4 |
| Ca(т) | 0 | 41,63 | 0 |
| CaCO3(т) | –1207,0 | 88,7 | –1127,7 |
| CaO(т) | –635,5 | 39,7 | –604,2 |
| Ca(OH)2(т) | –986,6 | 76,1 | –896,8 |
| Cl2(г) | 0 | 222,9 | 0 |
| Cu(т) | 0 | 33,3 | 0 |
| CuO(т) | –162,0 | 42,6 | –129,9 |
| Cu(OH)2(т) | –444,0 | 70,2 | –359,8 |
| Fe(т) | 0 | 27,15 | 0 |
| FeO(т) | –264,8 | 60,8 | –244,3 |
| Fe2O3(т) | –822,2 | 87,4 | –740,3 |
| Fe3O4(т) | –1117,1 | 146,2 | –1014,2 |
| FeCl3(т) | –401,8 | 119,4 | –302,0 |
| Fe(OH)3(т) | –841,0 | 96,6 | –6946 |
| F2(г) | 0 | 202,9 | 0 |
| H2(г) | 0 | 130,52 | 0 |
| HBr(г) | –36,3 | 198,6 | –53,3 |
| HCN(г) | 135,0 | 113,1 | 125,5 |
| HCl(г) | –91,8 | 186,8 | –94,79 |
| HF(г) | –270,7 | 178,7 | –272,8 |
| HJ(г) | 26,6 | 206,5 | 1,8 |
| H2O(г) | –241,8 | 188,7 | –228,6 |
| H2O(ж) | –285,8 | 70,1 | –237,3 |
| H2S(г) | –21,0 | 205,7 | –33,8 |
| H2SO4(ж) | –813,99 | 156,90 | –690,14 |
| J2(т) | 0 | 116,7 | 0 |
| J2(г) | 0 | 260,6 | 0 |
Окончание прил. 3
| Вещество | ΔН0298, кДж/моль | S0298, Дж/(моль·К) | ΔG0298, кДж/моль |
| К | 0 | 64,3 | 0 |
| КОН | –424,7 | 59,4 | –380,2 |
| Mg(т) | 0 | 32,5 | 0 |
| MgO(т) | –601,8 | 26,9 | –569,6 |
| Mg(OH)2(т) | –924,66 | 63,18 | –833,75 |
| MgSO4(т) | –1287,42 | 91,55 | –1173,25 |
| MgСO3(т) | –1113 | 65,7 | –1029,3 |
| N2(г) | 0 | 191,5 | 0 |
| NH3(г) | –46,2 | 192,6 | –16,7 |
| NH4Cl(т) | –315,39 | 94,5 | –204,0 |
| NH4NO3(т) | –365,4 | 151 | –183,8 |
| NO(г) | 90,3 | 210,6 | 86,6 |
| NO2(г) | 33,5 | 240,2 | 51,5 |
| Na(т) | 0 | 51,4 | 0 |
| NaOH(т) | –426,3 | 64,2 | –380,7 |
| Ni(т) | 0 | 29,8 | 0 |
| NiO(т) | –239,7 | 38,0 | –211,6 |
| O2(г) | 0 | 205,0 | 0 |
| O3(г) | 0 | 238,8 | 0 |
| OF2(г) | 25,1 | 247,0 | 42,5 |
| Р(белый) | 0 | 44,3 | 0 |
| Р(красный) | 0 | 22,8 | 0 |
| P2O3(т) | –820 | 173,5 | – |
| P2O5(т) | –1492 | 114,5 | –1348,8 |
| Pb(т) | 0 | 64,9 | 0 |
| PbO(т) | –219,3 | 66,1 | –189,1 |
| PbO2(т) | –276,6 | 74,9 | –218,3 |
| PCl3(г) | –287,02 | 311,71 | –267,98 |
| PCl5(г) | –374,89 | 364,47 | –305,10 |
| S(ромб,) | 0 | 31,8 | 0 |
| SO2(г) | –296,9 | 248,1 | –300,2 |
| SO3(г) | –395,8 | 256,7 | –371,2 |
| Si(т) | 0 | 18,7 | 0 |
| SiCl4(ж) | –687,8 | 239,7 | – |
| SiH4(г) | 34,7 | 204,6 | 57,2 |
| SiO2(т) | –910,9 | 41,8 | –856,7 |
| SnO(т) | –286,0 | 56,5 | –256,9 |
| SnO2(т) | –580,8 | 52,3 | –519,3 |
| SrCO3(т) | –1227,0 | 97,2 | –1255,97 |
| Ti(т) | 0 | 30,6 | 0 |
| TiCl4(ж) | –804,2 | 252,4 | –737,4 |
| TiO2(т) | –943,9 | 50,3 | –888,6 |
| TlH(г) | 204,62 | 215,1 | 140,52 |
| WO3(т) | –842,7 | 75,9 | –763,9 |
| Zn(т) | 0 | 41,6 | 0 |
| ZnO(т) | –350,6 | 43,6 | –320,7 |
ПРИЛОЖЕНИЕ 4
|
|
Таблица растворимости кислот, солей и оснований в воде
| Ионы | 
| 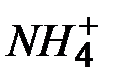
| 
| 
| 
| 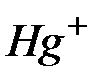
| 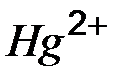
| 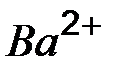
| 
| 
| 
| 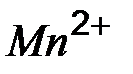
| 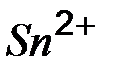
| 
| 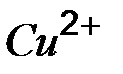
| 
| 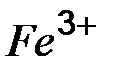
| 
| 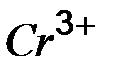
| 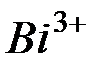
| 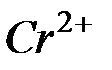
| 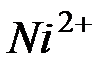
|
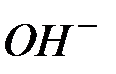
| – | – | – | м | м | н | н | н | м | н | н | н | н | н | н | н | н | |||||

| н | м | м | н | н | м | м | н | н | м | н | |||||||||||

| н | н | – | м | – | – | ||||||||||||||||
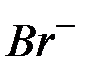
| н | н | м | – | ||||||||||||||||||
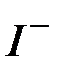
| н | н | н | м | н | – | – | – | ||||||||||||||
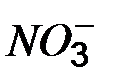
| – | |||||||||||||||||||||
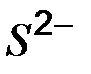
| н | н | н | м | н | н | н | н | н | н | – | – | – | н | н | н | ||||||
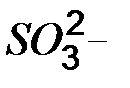
| н | н | н | н | н | н | н | н | – | н | н | н | – | – | – | н | – | н | ||||

| м | м | н | м | н | |||||||||||||||||
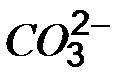
| м | м | н | н | н | н | н | н | н | – | н | н | н | н | – | – | н | – | н | |||

| н | – | н | – | – | н | н | н | н | н | н | н | н | н | н | н | н | – | н | н | ||
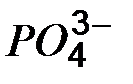
| н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | ||||

| м | |||||||||||||||||||||
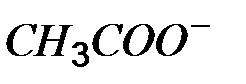
| м | м | ||||||||||||||||||||
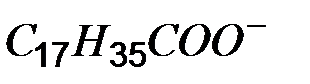
| н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н | н |

ПРИЛОЖЕНИЕ 5
Электрохимический ряд напряжения металлов
| Электрод | Электродный процесс | Значение 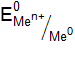 , В , В
|

| 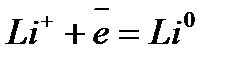
| –3,045 |
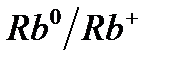
| 
| –2,925 |

| 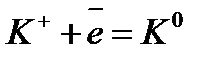
| –2,924 |

| 
| –2,923 |
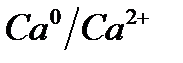
| 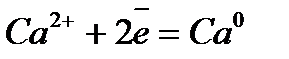
| –2,866 |
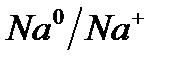
| 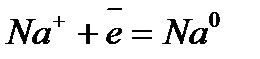
| –2,714 |

| 
| –2,363 |

| 
| –1,663 |

| 
| –1,630 |

| 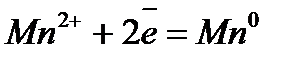
| –1,179 |
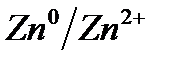
| 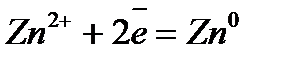
| –0,763 |
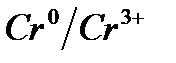
| 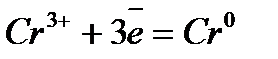
| –0,744 |

| 
| –0,440 |
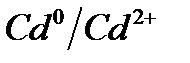
| 
| –0,403 |
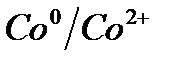
| 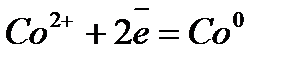
| –0,277 |

| 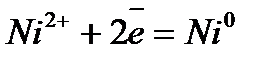
| –0,250 |
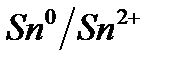
| 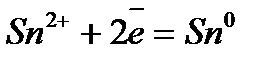
| –0,136 |

| 
| –0,126 |

| 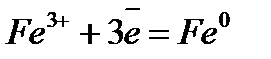
| –0,037 |
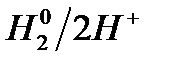
| 
| 0 |
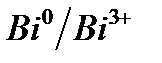
| 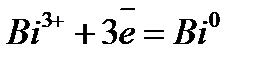
| 0,215 |

| 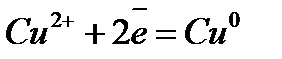
| 0,337 |

| 
| 0,520 |

| 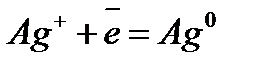
| 0,799 |
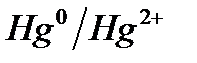
| 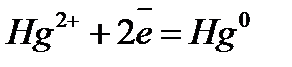
| 0,850 |

| 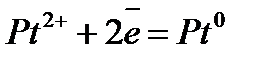
| 1,188 |
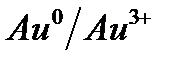
| 
| 1,498 |
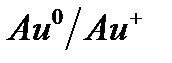
| 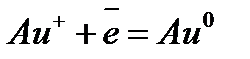
| 1,692 |
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ........................................................................................................ 3
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО НАПИСАНИЮ
И ОФОРМЛЕНИЮ контрольной РАБОТы и отчетов..................... 4
КРАТКОЕ СОДЕРЖАНИЕ ДИСЦИПЛИНЫ.................................................. 5
ВАРИАНТЫ КОНТРОЛЬНЫХ ЗАДАНИЙ................................................... 10
1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ....................................... 13
1.1. Теоретические сведения................................................................. 13
1.2. Примеры решения задач................................................................. 17
1.3. Индивидуальные задания............................................................... 19
2. СТРОЕНИЕ АТОМА................................................................................... 23
2.1. Теоретические сведения................................................................. 23
2.2. Примеры решения задач................................................................. 28
2.3. Индивидуальные задания............................................................... 30
3. ПЕРИОДИЧЕСКИЙ ЗАКОН.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА.. 32
3.1. Теоретические сведения................................................................. 32
3.2. Примеры решения задач................................................................. 39
|
|
3.3. Индивидуальные задания............................................................... 39
4. ХИМИЧЕСКАЯ СВЯЗЬ.............................................................................. 42
4.1. Теоретические сведения................................................................. 42
4.2. Примеры решения задач................................................................. 48
4.3. Индивидуальные задания............................................................... 49
5. СТРОЕНИЕ И СВОЙСТВО ТВЕРДОГО ВЕЩЕСТВА.......................... 50
5.1. Теоретические сведения................................................................. 50
5.2. Индивидуальные задания............................................................... 54
6. ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ.
НАПРАВЛЕНИЕ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ........ 56
6.1. Теоретические сведения................................................................. 56
6.2. Примеры решения задач................................................................. 61
6.3. Индивидуальные задания............................................................... 64
7. КИНЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ................................................................ 67
7.1. Теоретические сведения................................................................. 67
7.2. Примеры решения задач................................................................. 71
7.3. Индивидуальные задания............................................................... 73
8. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ............. 76
8.1. Теоретические сведения................................................................. 76
8.2. Примеры решения задач................................................................. 77
8.3. Индивидуальные задания............................................................... 78
9. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.
Реакции в растворах электролитов........................................ 80
9.1.Теоретические сведения.................................................................. 80
9.2. Примеры решения задач................................................................. 85
9.3. Индивидуальные задания............................................................... 87
10. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.................. 89
10.1. Теоретические сведения............................................................... 89
10.2. Примеры решения задач............................................................... 93
10.3. Индивидуальные задания............................................................. 95
11. ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ. РЯД НАПРЯЖЕНИЯ МЕТАЛЛОВ.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.......................................................... 96
11.1. Теоретические сведения............................................................... 96
11.2. Примеры решения задач............................................................ 100
11.3. Индивидуальные задания........................................................... 102
12. ЭЛЕКТРОЛИЗ......................................................................................... 106
12.1. Теоретические сведения............................................................ 106
12.2. Примеры решения задач............................................................ 111
|
|
12.3. Индивидуальные задания........................................................... 113
13. КОРРОЗИЯ МЕТАЛЛОВ....................................................................... 116
13.1. Теоретические сведения............................................................ 116
13.2. Примеры решения типовых задач............................................ 119
13.3. Индивидуальные задания........................................................... 121
Заключение.............................................................................................. 124
БИБЛИОГРАФИЧЕСКИЙ СПИСОК........................................................... 125
ПРИЛОЖЕНИЕ 1. Образцы титульных листов
ПРИЛОЖЕНИЕ 2. Периодическая система элементов....... 128
ПРИЛОЖЕНИЕ 3. Термодинамические константы
веществ....................................................................... 129
ПРИЛОЖЕНИЕ 4. Таблица растворимости кислот,
солей и оснований в воде............................... 131
ПРИЛОЖЕНИЕ 5. Электрохимический ряд
напряжения металлов....................................... 132
Учебное издание
Муромцева Елена Владимировна
ХИМИЯ
Учебное пособие
Редактор А.А. Иванова
Технический редактор С.С. Заикина
————————————————————————————
План 2016 г. Поз. 9.28. Подписано в печать 17.03.2016.
Уч.-изд. л. 8,5. Усл. печ. л. 7,9. Зак. 23. Тираж 200 экз. Цена 235 руб.
————————————————————————————
Издательство двгупс
* В задачах на квантовые числа существует определенная условность. Мы полагаем, что самый первый электрон, начинающий заселять электронное облако в любом атоме, имеет спин s = +1/2. На самом деле для электронов со спином +1/2 и
–1/2 это равновероятно. Так, при образовании атомов водорода в недрах звезд все они имеют электронную оболочку 1s1, но 50 % атомов водорода имеют электроны с s = +1/2, и 50 % – электроны с s = –1/2. Приведенные здесь задачи предлагается решить в рамках введенной нами условности.



