
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительный потенциал.
Направление окислительно-восстановительной реакции Окислительную способность веществ характеризует окислительно-восстановительный потенциал Е0, размерность – вольт. Существуют справочные данные, в которых приведены стандартные окислительно-восстановительные потенциалы В любой окислительно-восстановительной реакции как в исходных веществах, так и в продуктах реакции, имеются сопряженные пары окислитель-восстановитель. Направление окислительно-восстановительной реакции обусловливает тот окислитель, у которого значение электродного потенциала больше. Окислительно-восстановительные реакции протекают самопроизвольно, если разность стандартных электродных потенциалов окислителя и восстановителя больше нуля ( По известному значению
где
Окислительно-восстановительные эквиваленты
Окислители и восстановители в реакциях реагируют друг с другом в эквивалентных количествах. Молярная масса эквивалента определяется по формуле
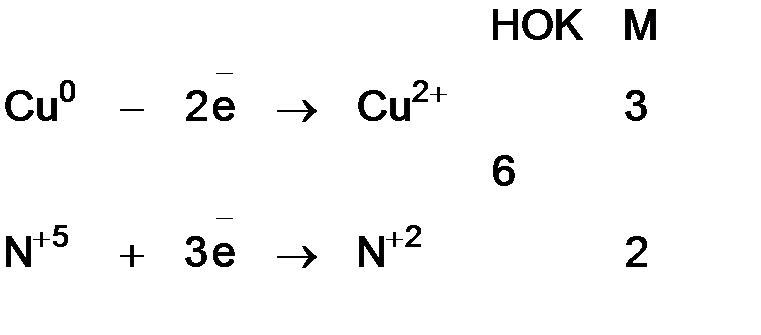
где Метод электронного баланса При уравнивании окислительно-восстановительных реакций в основе процесса подбора коэффициентов лежит закон сохранения материи: равенство числа атомов каждого элемента и равенство чисел отданных и принятых электронов. Порядок уравнивания 1. Написать реакцию в молекулярной форме (пример): 2. Определить степени окисления элементов, выбрать, для каких элементов степени окисления меняются: 3. Составить схемы электронных переходов для элементов изменивших свои степени окисления в ходе реакций и определить окислитель, восстановитель:
4. Уравнять число отданных и полученных электронов с помощью соответствующих множителей М, найденных с помощью наименьшего общего кратного (НОК) для числа отданных в процессе окисления и принятых в процессе восстановления электронов:
5. Перенести полученные коэффициенты в уравнение реакции перед окислителем и его восстановленной формой и восстановителем и его окисленной формой. Затем уравнять катионы и анионы, далее уравнять водород и проверить материальный баланс по кислороду, если баланса нет, следует проверить правильность определения степеней окисления элементов, изменившие свое состояние в левой и правой части уравнения:
Примеры решения задач
Пример 1. Составить электронные уравнения, подобрать коэффициенты для окислительно-восстановительной реакции:
Решение. Коэффициенты определим методом электронного баланса, для этого расставим степени окисления для каждого атома в соединениях, пользуясь правилами на странице:
Составим электронные уравнения, т.е. выпишем атомы (в уравнении они выделенные жирным шрифтом), изменившие степени окисления и определим окислительно-восстановительные процессы:
Для составления общего уравнения реакции необходимо уравнять число отданных и принятых электронов, по НОК (см. выше) и сложить полуреакции с учетом коэффициентов
_______________________________
Перенесем коэффициенты в уравнение реакции:
Переход к молекулярному уравнению осуществляется за счет равенства атомов каждого элемента в правой и левой частях уравнения:
Признаком правильного подбора коэффициентов уравнения является баланс по кислороду левой и правой частей уравнения: 24 = 24.
Пример 2. Указать, каким является приведенный процесс Решение.
Пример 3. Определить, с каким галогенидом калия возможная реакция в прямом направлении. 2КГ(р) + 2FeCl3(р) = Г2 + 2КCl(р) + 2FеCl2(р), где Г – галогены (F, Сl, Вr, I). Решение. Расставим степени окисления: 2К+Г– + 2Fe+3
По справочным данным находим значения потенциалов
вычислим разницу
Полученные результаты означают, что только иодид калия восстанавливает FeCl3, так как Окислительные свойства галогенов ослабевают в ряду F2 > Cl2 > Br2 > I2.
10.3. Индивидуальные задания
Составить электронные уравнения (табл. 10.1), подобрать коэффициенты для окислительно-восстановительной реакции, рассчитать молярные массы эквивалентов окислителя или восстановителя (см. табл. 10.1 столбец А (о – окислитель, в – восстановитель)) и энергию Гиббса. Определить возможность протекания реакции в прямом направлении. Таблица 10.1 Варианты контрольного задания
|
||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 360; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.53.209 (0.008 с.) |
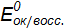 , измеренные относительно
, измеренные относительно 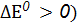 или по изменению энергии Гиббса реакции (
или по изменению энергии Гиббса реакции (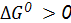 ).
).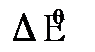 можно вычислить энергию Гибба
можно вычислить энергию Гибба 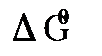 и константу равновесия Кр окислительно-восстановительной реакции:
и константу равновесия Кр окислительно-восстановительной реакции: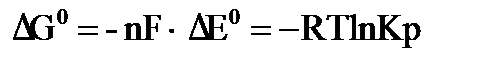 , (10.1)
, (10.1)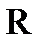 – универсальная газовая постоянная, равная 8,314 Дж/(моль·град);
– универсальная газовая постоянная, равная 8,314 Дж/(моль·град); 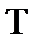 – абсолютная температура, К;
– абсолютная температура, К; 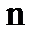 – число электронов, участвующих в электродном процессе;
– число электронов, участвующих в электродном процессе; 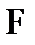 – постоянная Фарадея;
– постоянная Фарадея; 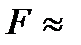 96500 Кл/моль.
96500 Кл/моль.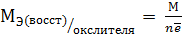 , (10.2)
, (10.2)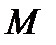 – молярная масса окислителя или восстановителя;
– молярная масса окислителя или восстановителя; 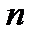 – число электронов, перемещаемых одной молекулой.
– число электронов, перемещаемых одной молекулой.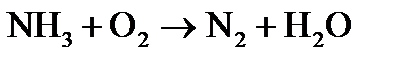 .
.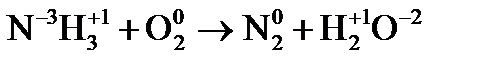 .
.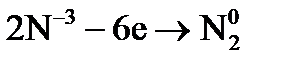 – процесс окисления;
– процесс окисления;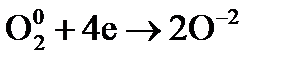 – процесс восстановления.
– процесс восстановления. – восстановитель;
– восстановитель;  – окислитель.
– окислитель.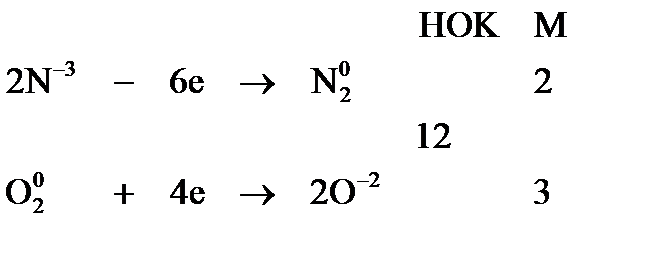
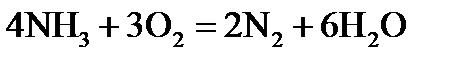 .
.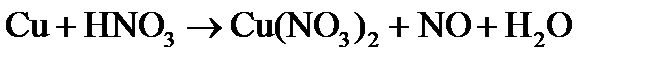 .
.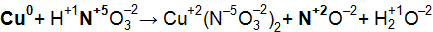 .
.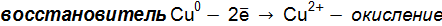 ;
;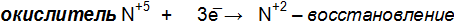 .
.
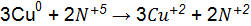
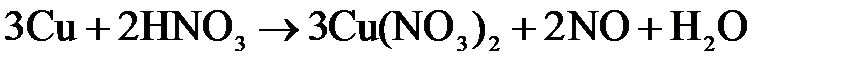 .
.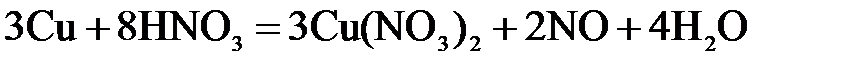 .
. – окислительным или восстановительным, – и рассчитать молярную массу эквивалента восстановителя (окислителя).
– окислительным или восстановительным, – и рассчитать молярную массу эквивалента восстановителя (окислителя).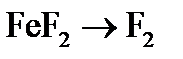 ,
, 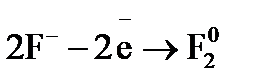 – процесс окисления, а
– процесс окисления, а  – восстановитель, по формуле (10.2) определяем молярную массу восстановителя:
– восстановитель, по формуле (10.2) определяем молярную массу восстановителя: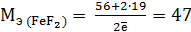 г/моль.
г/моль.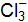 (р) = Г20 + 2Fe+2
(р) = Г20 + 2Fe+2 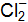 + 2К+Cl–;
+ 2К+Cl–;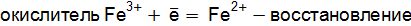 ;
;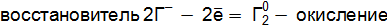 .
.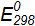 для электродных реакций:
для электродных реакций: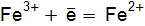
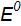 = +0,77 B
= +0,77 B
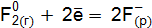
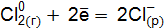
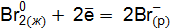
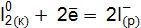
 реакции с участием галогенидов для:
реакции с участием галогенидов для: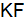
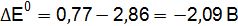 ;
;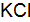
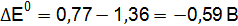 ;
;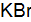
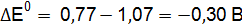 ;
;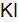
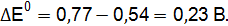
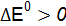 .
.


