
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электродный потенциал. Ряд напряжения металлов.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ Теоретические сведения
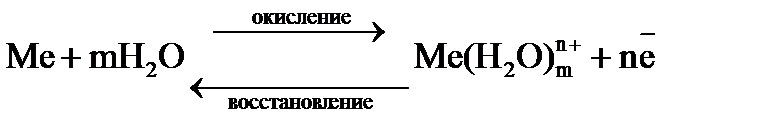
Вследствие возникновения на границе металл–раствор двойного электрического слоя, между металлом и раствором возникает разность потенциалов Dj, которая называется электродным потенциалом металла. Со временем отрицательный заряд поверхности металла и положительный заряд раствора увеличивается, и выход гидратированных ионов в раствор уменьшается. Наряду с этим, протекает обратный процесс. При некотором значении электродного потенциала металла устанавливается равновесие
в упрощенном виде записывается
Этому равновесию отвечает потенциал, называемый равновесным электродным потенциалом. Это равновесие подвижно и на него можно воздействовать, изменяя условия. Отвод электронов из металла сместит равновесие вправо, а повышение концентрации ионов металла в растворе смещает равновесие влево. Абсолютное значение электродного потенциала определить невозможно. Электродные потенциалы любого электрода принято выражать по отношению к нормальному (стандартному) водородному электроду, потенциал которого условно принят равным нулю (
Устройство, в котором энергия химической реакции непосредственно превращается в электрическую энергию, называется гальваническим элементом (рис. 11.2).
Рис. 11.2. Медно-цинковый гальванический элемент (элемент Даниэля–Якоби)
Для измерения потенциала отдельного электрода составляют гальванический элемент из стандартного водородного электрода (эталона) и электрода, потенциал которого хотят измерить. Таким образом, потенциалом электрода называется разность потенциалов гальванического элемента, составленного из измеряемого электрода и электрода сравнения. Если активность ионов металла в растворе равна единице Стандартные электродные потенциалы металлов (в вольтах) представлены в ряде стандартных электродных потенциалов, который включает стандартный водородный электрод. Такой ряд получил название ряда стандартных электродных потенциалов металлов или ряда напряжения (см. прил. 5). Пользуясь рядом напряжения, можно сделать следующие выводы: · каждый металл способен восстанавливать из растворов солей все ионы металлов, имеющие большее значение электродных потенциалов; · величина стандартного электродного потенциала металла характеризует одновременно восстановительную способность его атомов и окислительную способность его ионов. Чем меньше алгебраическая величина стандартного электродного потенциала, тем больше восстановительная способность атома данного металла и, наоборот, тем меньше окислительная способность его иона. · водород из растворов кислот (искл. HNO3 (кон), HNO3 (раз), H2SO4 (кон)) может быть вытеснен только металлами, стандартные электродные потенциалы которых имеют знак минус и отличается от 0,000 В не менее, чем на 200 мВ. Величина электродного потенциала зависит от природы вещества, от активности его ионов в растворе, от температуры и выражается уравнением Нернста:
где Из обобщенного уравнения получают формулы для расчета потенциалов различных типов электродов. В электродах первого род а, так называемых металлических электродах, восстановленной формой является металл, а окисленной – ион этого металла. Металлический электрод, представляет собой металл, контактирующий с раствором, содержащим катионы данного металла. Эти электроды являются обратимыми по катиону, т.е. электродный потенциал является функцией активности катиона (
где В приблизительных расчетах вместо активностей ионов металла можно пользоваться их концентрациями (
Гальванические элементы
Примером простейшего гальванического элемента может служить медно-цинковый элемент Даниэля–Якоби. Элемент записывается так: (–) В этом элементе электрическая энергия складывается: – из окислительного процесса на цинковой пластинке – восстановительного процесса на медной Суммарная химическая реакция, протекающая в гальваническом элементе, при помощи которой можно получить электрическую энергию, называется токообразующей реакцией (ТОР): Общую схему гальванического элемента можно записать: (–) Электрод | электролит 1 || электролит 2 | Электрод (+). Электрод, на котором протекает процесс окисления материала электрода, имеет знак (–), и его электродный потенциал имеет меньшее значение. Электрод, на котором протекает процесс восстановления ионов из среды, имеет знак (+). Вертикальная черта означает границу раздела фаз, двойная вертикальная черта – диафрагма, пористая перегородка или электролитический ключ. Окислительно-восстановительная реакция, которая лежит в основе работы гальванического элемента, протекает в направлении, в котором разность равновесных потенциалов положительного и отрицательного электродов элемента имеет положительное значение, а энергия Гиббса Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента называется электродвижущей силой элемента Связь между химической и электрической энергиями осуществляется уравнением
Таким образом, при известных значениях энергии Гиббса Примеры решения задач
Пример 1. Рассмотрите возможность протекания реакции окисления магния в растворе хлорида хрома с молярной концентрацией ионов хрома
Решение. Реакция протекает, если разность потенциалов Находим стандартные электродные потенциалы в прил. 5: Пример 2. Составьте схему гальванического элемента, в котором электродами является магниевая и цинковая пластинки, опущенные в растворы их ионов с концентрацией 1 моль×дм–3. Какой металл является отрицательным электродам, какой положительным электродом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, вычислите максимальную разность потенциалов электродов, которая может быть получена при работе гальванического элемента. Решение. Магний имеет меньший потенциал (
Процессы, протекающие на электродах: отрицательный Уравнение окислительно-восстановительной реакции, которое лежит в основе работы данного гальванического элемента, можно получить, сложив электронные уравнения электродных процессов: Для определения
Пример 3. Составьте схемы гальванических элементов, в одном из которых медь является положительным электродом, а в другом – отрицательным. Напишите для каждого элемента уравнения реакций. Решение. Отрицательным электродом является всегда более активный металл, положительным электродом менее активный. Из электрохимического ряда напряжения металлов выбираем соответствующие металлы: Схема первого гальванического элемента, где медь – положительный электрод: Процессы, протекающие на электродах: на (–): на (+): Уравнение ТОР, которая лежит в основе работы данного гальванического элемента: Схема второго гальванического элемента, где медь – отрицательный электрод: Процессы, протекающие на электродах:
на (–): на (+): Уравнение ТОР, которая лежит в основе работы данного гальванического элемента:
Пример 4. Составьте схемы гальванических элементов, в основе которых лежит реакция, протекающая по уравнению Решение. Из уравнения реакции Схема данного гальванического элемента: Для нахождения энергии Гиббса воспользуемся формулой (11.4). Для определения
11.3. Индивидуальные задания
291. а. Составьте схему гальванического элемента, в основе которого лежит токообразующая реакция, протекающая по уравнению б. Каковы особенности строения границы раздела двух фаз при наличии в системе ионов и других заряженных частиц? 292. а. Составьте схемы гальванических элементов, в одном из которых цинк является положительным электродом, а в другом – отрицательным. Напишите для каждого элемента уравнения токообразующей реакции. б. Каковы причины обусловливающие возникновение скачка потенциала на границе фаз? 293. а. Составьте схему гальванического элемента, в котором электродами являются железная и кобальтовая пластинки, опущенные в растворы их ионов с концентрацией ионов: б. Что такое гальванический элемент? 294. а. Рассмотрите возможность (невозможность) протекания реакций окисления металлов в растворах солей с концентрацией 1 б. Что называется электродвижущей силой элемента? Может ли ЭДС быть величиной отрицательной? 295. а. Определите, какой из перечисленных металлов – Ag, Zn, Fe,
б. Что такое стандартный водородный электрод? 296. а. Как изменится масса цинковой пластинки, если находится в растворах хлорида меди, нитрата свинца, сульфата натрия? Ответ пояснить. Составьте электронные молекулярные уравнения соответствующих реакций. б. Что означает термин «электродный потенциал»? 297. а. Как должна быть составлена гальваническая цепь для осуществления б Что означает термин «стандартный электродный потенциал»? 298. а. Вычислите электродный потенциал медной пластинки, погруженной в 0,1 М раствор своей соли. б. Как схематично изображается гальванический элемент? 299. а. Вычислите потенциал серебряного электрода, опущенного в раствор соли серебра с концентрацией 0,001 б. Какие процессы протекают в гальванических элементах? В чем состоит их особенность? 300. а. Составьте схемы двух гальванических элементов, в одном из которых кадмий является анодом, а в другом – катодом. Напишите уравнения электродных процессов и вычислите ЭДС (условия стандартные) каждого элемента. б. В чем отличие электродов I рода от электродов II рода? 301. а. Составьте гальванический элемент, напишите уравнения электродных процессов и вычислите стандартную ЭДС, токообразующая реакция которого выражается уравнением: б. Как изменяется потенциал электрода, обратимого относительно катиона, с ростом концентрации? 302. а. Как изменится масса цинковой пластины (уменьшится, увеличится, останется без изменений), погруженной в водный раствор соли серебра? Ответ обоснуйте. б. Где практически применяют гальванические элементы? 303. а. Гальванический элемент составлен по схеме: б. Как классифицируют электроды? 304. а. Какие из указанных металлов растворяются в разбавленной соляной кислоте: Pt, Zn, Cu, Ni, Sn? Напишите уравнения реакций и составьте электронные уравнения. В каком случае реакция будет протекать более интенсивно? Ответ поясните расчетом. б. Как можно увеличить ЭДС гальванического элемента? 305. а. Вычислите потенциал магниевого электрода погруженного в раствор хлорида магния с молярной концентрацией эквивалента б. Что такое концентрационный гальванический элемент, какие процессы протекают на электродах? 306. а. В каком из указанных гальванических элементов железный электрод является катодом: Fe½НCl½Cu; б. Что такое аккумуляторы? Какие электролиты используются в аккумуляторах? 307. а. Если пластинку цинка опустить в разбавленную соляную кислоту, то начинающееся выделение водорода вскоре почти прекратиться. При прикосновении к цинку медной пластинкой на последней начинается бурное выделение водорода. Дайте этому объяснение. Напишите соответствующие уравнения. б. От чего зависит величина электродного потенциала металла? 308. а. Составьте схему, напишите уравнения электродных процессов элемента, состоящего из серебряной и магниевой пластин, опущенных в раствор, содержащий ионы этих металлов с молярной концентрацией 1 б. Как можно определить электродный потенциал металла? 309. а. В каком из указанных гальванических элементов – Fe½HCl½Cu; б. Что такое первичные источники тока? Приведите пример. 310. а. В раствор соляной кислоты поместили две цинковые пластинки, одна из которых частично покрыта никелем. В каком случае процесс коррозии происходит интенсивнее? Ответ мотивируйте, составив уравнения соответствующих процессов. б. Щелочные аккумуляторы, его устройство, процессы, протекающие при работе. 311. а. Вычислите электродные потенциалы цинковой пластинки, погруженной в 0,1 М, 0,001 М растворы своей соли. Составьте гальванический элемент, указав катод и анод. Рассчитайте ЭДС элемента. б. Кислотный аккумулятор, его устройство и процессы, протекающие при работе. 312. а. Вычислите потенциал кадмиевого электрода, если кадмиевая пластинка погружена в 100 см3 раствора, в котором содержится сульфат кадмия массой 0,208 г. б. Элемент Вольта, его устройство и принцип действия. 313. а. Вычислите ЭДС и определите DG гальванического элемента б. В каких случаях будут протекать окислительно-восстановительные реакции 314. а. Вычислите концентрацию ионов б. Устройство и назначение водородного электрода. 315. а. Вычислите б. Вычислите потенциал алюминиевого электрода, погруженного в раствор объемом 120 316. а. Как должна быть составлена гальваническая цепь для осуществления реакции б. Рассчитайте электродные потенциалы цинка в растворе хлорида цинка при концентрациях 317. а. Из каких электродов следует составить гальванический элемент для получения максимальной эдс: а) б. Топливный элемент назначение, устройство. 318. а. Составьте схему, напишите электронные уравнения электродных процессов и вычислите эдс гальванического элемента, электроды которого выполнены из никеливой и кадмиевой пластин, в растворе собственных солей с концентрацией ионов б. Укажите, где применяются солевые батареи, какие химические процессы протекают на электродах. Приведите схему и запишите реакции. 319. а. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите эдс гальванического элемента, в котором цинковые электроды опущены в 0,002 н и 0,01н растворы сульфата цинка. б. Какие химические процессы протекают на электродах при зарядке и разрядке железоникелевого аккумулятора? 320. а. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на электродах. б. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора? Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на электродах.
ЭЛЕКТРОЛИЗ Теоретические сведения
Электролизом называется процесс разложения расплавов или растворов электролитов под действием постоянного электрического тока. Электролизер (электролитическая ячейка для электролиза) содержит раствор или расплав электролита, в который погружены два электрода. Окислительно-восстановительные реакции в электролизере, связанные с отдачей или присоединением электронов, происходят на электродах. Электрод, на котором протекает процесс восстановления (катод) в электролизере подключен к отрицательному полюсу, а электрод, на котором протекает процесс окисления (анод), подключен к положительному полюсу внешнего источника тока. Электроны с анода уходят во внешнюю цепь. В зависимости от природы анода источником этих электронов является или сам анод, который в этом случае является растворимым, или анионы из раствора или расплава; в этом случае анод называется нерастворимым. Прохождение электрического тока через ячейку вызывает изменение потенциалов электродов. Отклонение потенциала электрода от его равновесного значения при прохождении тока через этот электрод называется поляризацией. Величину поляризации Поляризация может наблюдаться как на катоде, так и на аноде, поэтому различают катодную Электродные процессы при электролизе зависят от природы электролита, от того, находится ли электролит в виде расплава или используется его раствор, и от материала электродов.
Применение электролиза
Электролиз широко используется в различных областях народного хозяйства. В энергетике водород, полученный электролизом, используют для охлаждения генераторов на тепловых и атомных электростанциях. Также электролизом получают кислород, хлор и другие газы. Электролизом растворов солей получают медь, цинк, кадмий, никель, кобальт, марганец и другие металлы. В этих процессах используют нерастворимые аноды. Электролизом расплавов соединений получают алюминий, магний, натрий, литий, бериллий и кальций, а также сплавы некоторых металлов. Электролиз используют для рафинирования (очистки) таких металлов, как медь, золото, серебро, свинец, олово и др., от примесей. Когда поверхностный слой анода очистился от железа, начинает растворяться медь и переносится на катод, более же благородные серебро и золото не переносятся вовсе, пока имеется медь, и падают с анода на дно ванны в виде тонкого ила, откуда по окончании процесса и извлекаются. В некоторых рудах имеется настолько значительное содержание серебра и золота, что их извлечение из ила покрывает все расходы по рафинированию меди. Серебро, золото, платина также очищаются рафинированием. Электролиз используется для нанесения металлических покрытий на металлы и пластмассы, для защиты от коррозии и придания поверхности декоративного вида. При этом катодом служит обрабатываемое изделие, анодом – или металл покрытия, или нерастворимый электрод. Электрохимическое полирование – анодная обработка металла для создания ровной поверхности. Изделие, имеющее микронеровности на поверхности, является анодом электролизера, катодом служит металл не растворимый в растворе электролита. Метод электролиза находит широкое применение в ремонтно-восстановительных работах различных отраслей промышленности.
Электролиз расплава При высоких температурах кристаллическая решетка соли разрушается и образуется расплав, в котором ионы могут свободно перемещаться. Рассмотрим электролиз расплава хлористого натрия. Если в расплавленную соль погрузить два графитовых электрода и подключить к полюсам источник тока, то катионы На катоде катионы Анод выступает по отношению к анионам хлора как окислитель – отбирает у них электроны: Уравнение электролиза:
Электролиз раствора Электролиз раствора отличается от электролиза расплава тем, что в растворе, помимо ионов соли, есть молекулы, которые могут принимать участие в процессе. При электролизе растворов руководствуются следующими правилами. Процессы на катоде зависят от активности катионов металла. Так как идет реакция восстановления, то восстанавливаются наиболее сильные окислители (катионы с наиболее положительным потенциалом). 1. В первую очередь, восстанавливаются катионы неактивных металлов, которые в электрохимическом ряду напряжений стоят правее водорода, к ним относятся ионы 2. Вместо катионов активных металлов, которые стоят левее водорода (от 3. Катионы металлов средней активности, которые расположенны между алюминием и водородом, будут восстанавливаться одновременно с молекулами воды. Процессы на аноде В этом случае надо учитывать, из какого материала сделаны электроды. Нерастворимые (инертные) электроды (графит, платина) не участвуют в анодном процессе из-за высокого значения электродного потенциала, в то время как растворимые (активные) электроды участвуют в этом процессе. Нерастворимые (инертные) электроды. На аноде идет реакция окисления, поэтому в первую очередь должны реагировать сильные восстановители. 1. В первую очередь окисляются простые анионы 2. Вместо кислородосодержащих кислотных анионов 3. В щелочных растворах на аноде окисляются ионы Растворимые (а ктивные электроды) При использовании растворимых анодов (чаще всего это сплавы серебра, меди, цинка, железа и т.д. с примесями), при окислении атомы металлов отдают электроны: Пример. Рассмотрим электролиз раствора хлористого натрия на инертном электроде. В растворе хлористого натрия, кроме ионов На катоде молекулы воды могут присоединять электроны: На аноде молекулы воды могут отдавать электроны: Итак, при электролизе раствора В первую очередь, осуществляется тот процесс, который требует минимальной затраты энергии. Вода является более сильным окислителем и восстанавливается в первую очередь, на катоде при электролизе раствора
|
||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 1038; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.172.249 (0.112 с.) |
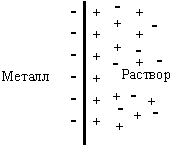 Рис. 11.1. Двойной электрический слой на границе раздела металл–раствор
Рис. 11.1. Двойной электрический слой на границе раздела металл–раствор
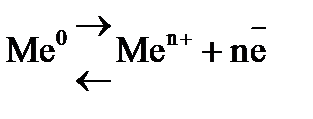 .
.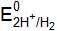 = 0 В).
= 0 В). 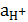 = 1 моль×дм–3 и Т = 298 К (стандартные условия).
= 1 моль×дм–3 и Т = 298 К (стандартные условия). 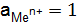 моль×дм–3) и Т = 298 К, давление 101 кПа, то ЭДС (электродвижущая сила) такого гальванического элемента (измеренная компенсационным методом) и есть стандартный электродный потенциал металла (
моль×дм–3) и Т = 298 К, давление 101 кПа, то ЭДС (электродвижущая сила) такого гальванического элемента (измеренная компенсационным методом) и есть стандартный электродный потенциал металла (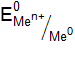 , В).
, В).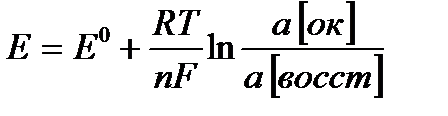 , (11.1)
, (11.1)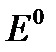 – стандартный электродный потенциал, В;
– стандартный электродный потенциал, В; 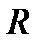 – универсальная газовая постоянная, равная 8,314 Дж/(моль·град);
– универсальная газовая постоянная, равная 8,314 Дж/(моль·град); 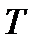 – абсолютная температура, К;
– абсолютная температура, К; 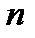 – число электронов, участвующих в электродном процессе;
– число электронов, участвующих в электродном процессе; 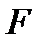 – постоянная Фарадея,
– постоянная Фарадея, 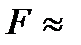 96500 Кл/моль;
96500 Кл/моль; 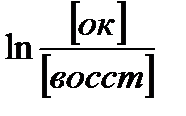 – натуральный логарифм отношения активностей окисленной и восстановленной формы вещества.
– натуральный логарифм отношения активностей окисленной и восстановленной формы вещества.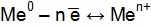 .
.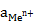 ):
):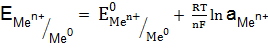 , (11.2)
, (11.2)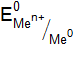 – стандартный электродный потенциал металла, В;
– стандартный электродный потенциал металла, В; 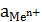 – активность ионов металла в растворе, моль×дм–3.
– активность ионов металла в растворе, моль×дм–3.  ) и, подставляя значения
) и, подставляя значения 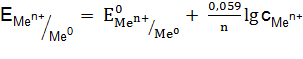 . (11.3)
. (11.3) |
| 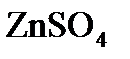 ||
|| 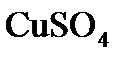 |
| 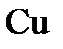 (+).
(+).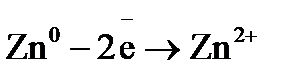 ;
;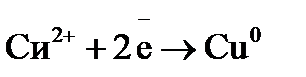 .
.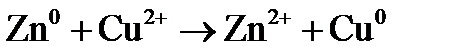 .
.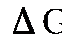 < 0.
< 0.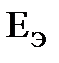 .
.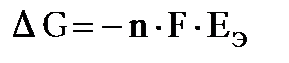 . (11.4)
. (11.4)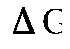 можно рассчитать
можно рассчитать 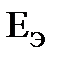 , и наоборот.
, и наоборот.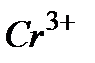 1 моль×дм–3.
1 моль×дм–3.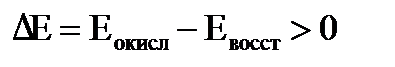 .
.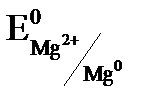 =
= 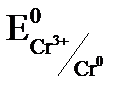 = –0,74 В. В реакции магний является восстановителем, так как
= –0,74 В. В реакции магний является восстановителем, так как 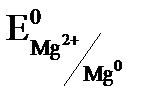 <
< 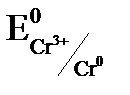 ,
, 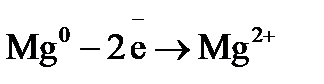 , хром окислителем и
, хром окислителем и 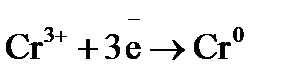 , определяем разность потенциалов:
, определяем разность потенциалов: 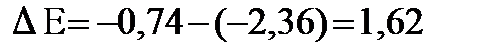 В, разница больше нуля, значит, реакция возможна:
В, разница больше нуля, значит, реакция возможна: 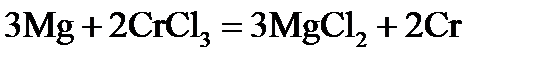 .
.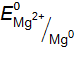 = –2,37 В) и является отрицательным электродом, цинк потенциал которого (
= –2,37 В) и является отрицательным электродом, цинк потенциал которого (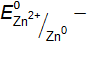 0,76 В) является положительным электродом. Схема данного гальванического элемента
0,76 В) является положительным электродом. Схема данного гальванического элемента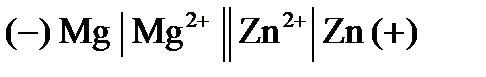 .
.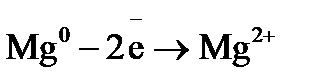 , положительный
, положительный 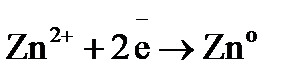 .
.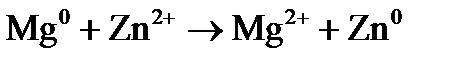 .
.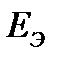 гальванического элемента из потенциала положительного электрода следует вычесть потенциал отрицательного электрода. Так как концентрация ионов в растворе равна 1 моль×дм–3, то
гальванического элемента из потенциала положительного электрода следует вычесть потенциал отрицательного электрода. Так как концентрация ионов в растворе равна 1 моль×дм–3, то 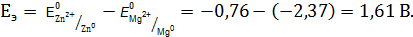
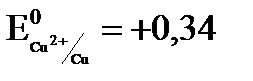 В,
В, 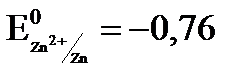 В,
В, 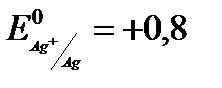 В. В качестве ионного проводника выберем растворы солей и раствор соляной кислоты.
В. В качестве ионного проводника выберем растворы солей и раствор соляной кислоты.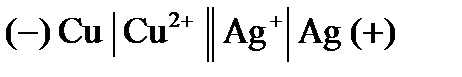 .
.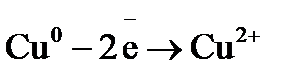 ;
;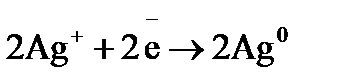 .
.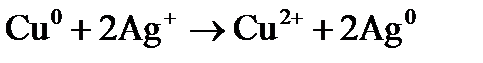 .
.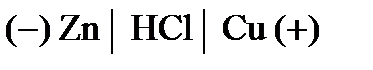 .
.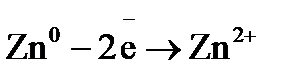 ;
;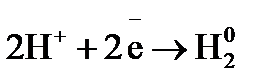 .
.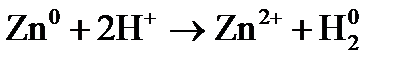 .
.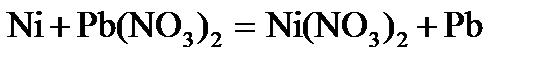 . Напишите уравнения окислительного и восстановительного процессов. Вычислите энергию Гиббса, если концентрация ионов никеля в растворе 0,01 моль×дм–3, а свинца 0,0001 моль×дм–3?
. Напишите уравнения окислительного и восстановительного процессов. Вычислите энергию Гиббса, если концентрация ионов никеля в растворе 0,01 моль×дм–3, а свинца 0,0001 моль×дм–3?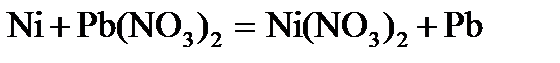 определяем, что никель окисляется:
определяем, что никель окисляется: 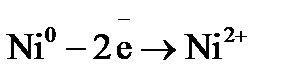 , а свинец восстанавливается:
, а свинец восстанавливается: 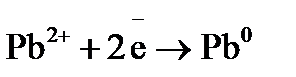 , следовательно, никель будет отрицательным электродом, свинец – положительным. если сравнить стандартные электродные потенциалы металлов (см. прил. 5), то
, следовательно, никель будет отрицательным электродом, свинец – положительным. если сравнить стандартные электродные потенциалы металлов (см. прил. 5), то 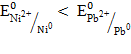 , следовательно, никель по отношению к свинцу будет более активным металлом. В гальваническом элементе активный металл всегда окисляется и является отрицательным электродом, на положительном электроде идет восстановление ионов из среды. В данном случае средой является раствор соли нитрата свинца, поэтому ионы свинца восстанавливаются на положительном электроде. В качестве электрода можно выбрать металл, потенциал которого меньше, чем у никеля, но чаще выбирают тот металл, ионы которого восстанавливаются.
, следовательно, никель по отношению к свинцу будет более активным металлом. В гальваническом элементе активный металл всегда окисляется и является отрицательным электродом, на положительном электроде идет восстановление ионов из среды. В данном случае средой является раствор соли нитрата свинца, поэтому ионы свинца восстанавливаются на положительном электроде. В качестве электрода можно выбрать металл, потенциал которого меньше, чем у никеля, но чаще выбирают тот металл, ионы которого восстанавливаются.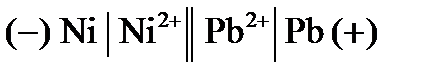 .
.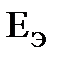 найдем значения электродных потенциалов по формуле (11.3)
найдем значения электродных потенциалов по формуле (11.3)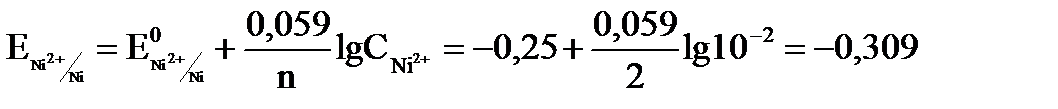 В;
В;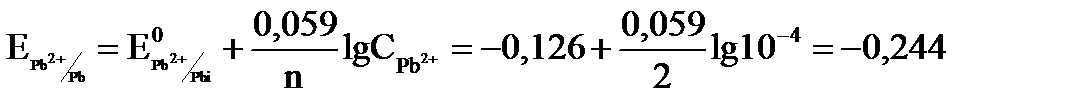 В;
В;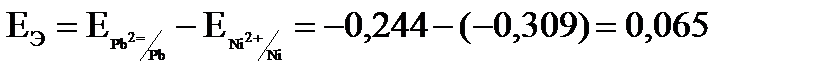 В;
В;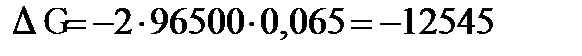 кДж/моль.
кДж/моль.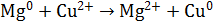 . Напишите уравнения электродных процессов.
. Напишите уравнения электродных процессов.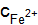 = 0,1
= 0,1 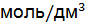 ,
, 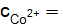 0,01
0,01 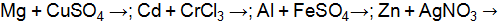 . Какая реакция будет протекать наиболее интенсивно? Ответ поясните расчетом.
. Какая реакция будет протекать наиболее интенсивно? Ответ поясните расчетом. 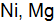 – способен взаимодействовать с раствором соляной кислоты.
– способен взаимодействовать с раствором соляной кислоты. 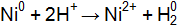 ? Напишите уравнения электродных процессов.
? Напишите уравнения электродных процессов.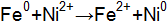 .
. . Вычислите стандартную ЭДС этого элемента.
. Вычислите стандартную ЭДС этого элемента. 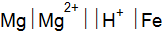 ? Какие процессы протекают в элементе? Напишите уравнения электродных процессов.
? Какие процессы протекают в элементе? Напишите уравнения электродных процессов.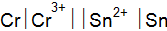 , напишите уравнения анодного и катодного процессов.
, напишите уравнения анодного и катодного процессов.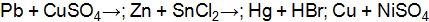 ? Какая реакция протекает наиболее интенсивно? Ответ подтвердить расчетом.
? Какая реакция протекает наиболее интенсивно? Ответ подтвердить расчетом.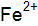 в растворе хлорида железа при 298 К, если потенциал электрода в указанном растворе
в растворе хлорида железа при 298 К, если потенциал электрода в указанном растворе 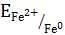 = –0,477 B.
= –0,477 B.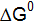 элемента Fe/HCl/Cu. Укажите, какой из электродов является отрицательным. Напишите уравнения реакций, протекающих на аноде и катоде и покажите движение электроном по цепи.
элемента Fe/HCl/Cu. Укажите, какой из электродов является отрицательным. Напишите уравнения реакций, протекающих на аноде и катоде и покажите движение электроном по цепи. , содержащий 0,1 г хлорида алюминия.
, содержащий 0,1 г хлорида алюминия.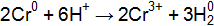 ? Напишите электронные уравнения, найдите ЭДС данного элемента.
? Напишите электронные уравнения, найдите ЭДС данного элемента.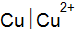 и
и 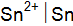 ;
; 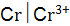 и
и 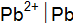 ; в)
; в)  и
и 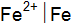 ?
?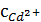 = 0,80
= 0,80 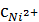 = 0,01
= 0,01 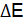 определяют по разности между потенциалом при прохождении тока
определяют по разности между потенциалом при прохождении тока 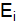 и равновесным потенциалом
и равновесным потенциалом 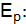
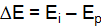 .
.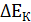 и анодную
и анодную 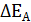 поляризацию. Вследствие катодной поляризации потенциал катода становится более отрицательным, а из-за анодной поляризации потенциал анода – более положительным.
поляризацию. Вследствие катодной поляризации потенциал катода становится более отрицательным, а из-за анодной поляризации потенциал анода – более положительным.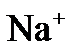 будут перемещаться к катоду, а анионы
будут перемещаться к катоду, а анионы 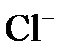 – к аноду.
– к аноду. 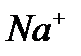 присоединяют к себе электроны (восстанавливаются), образуя металлический натрий:
присоединяют к себе электроны (восстанавливаются), образуя металлический натрий: 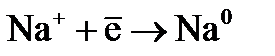 .
.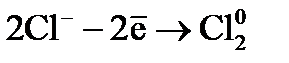 .
.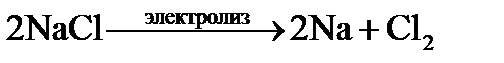 .
.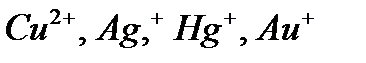 – платиновых металлов.
– платиновых металлов.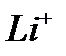 до
до 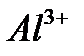 включительно), будут восстанавливаться молекулы воды
включительно), будут восстанавливаться молекулы воды 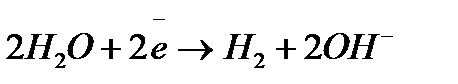 , а в кислой среде – ионы водорода
, а в кислой среде – ионы водорода 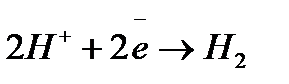 .
.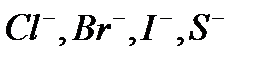 .
.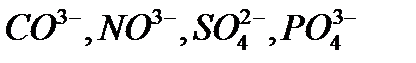 на аноде окисляются молекулы воды:
на аноде окисляются молекулы воды: 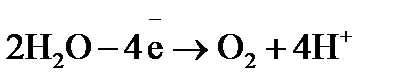 .
. :
: 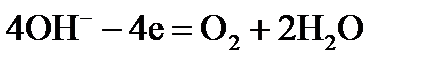 .
.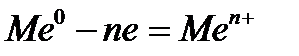 , образующиеся при этом катионы металлов
, образующиеся при этом катионы металлов  переходят в раствор.
переходят в раствор. и
и 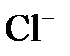 , имеются молекулы воды, которые могут участвовать в электродном процессе.
, имеются молекулы воды, которые могут участвовать в электродном процессе.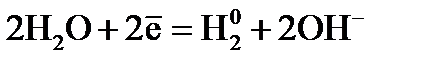 .
.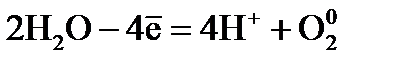 .
.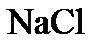 могут протекать следующие процессы: на катоде –
могут протекать следующие процессы: на катоде – 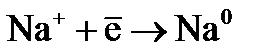 ,
, 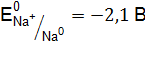 ,
, 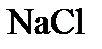 имеет
имеет  = 7, т.е. [
= 7, т.е. [ 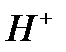 ] = 10–7, то электродный потенциал для процесса восстановления ионов водорода будет отличаться от равновесного:
] = 10–7, то электродный потенциал для процесса восстановления ионов водорода будет отличаться от равновесного: 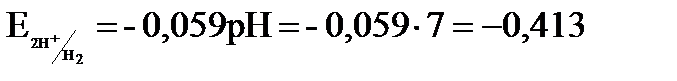 В.
В. протекает следующий процесс –
протекает следующий процесс – 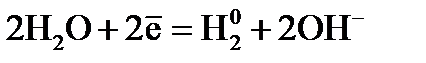 (с наиболее положительным потенциалом).
(с наиболее положительным потенциалом).


