
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Активность и ионная сила растворов сильных электролитов
Свойства растворов сильных электролитов указывают на формально неполную диссоциацию последних. Это связано с электростатическим (Кулоновским) взаимодействием между ионами, окруженными сольватными оболочками. Количественной характеристикой взаимодействия является коэффициент активности f. Коэффициент активности f показывает, насколько поведение ионов в растворе сильного электролита при данной концентрации отличается от их поведения при бесконечном разбавлении. Фактическая (активная) концентрация ионов уменьшается. Аналитически молярная концентрация катионов и анионов (
где f – коэффициент активности; Для определения f нужно вычислить ионную силу раствора. Ионной силой раствора называется полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат их зарядов:
I = 0,5å
где Уравнение Дебая-Хюккеля позволяет найти коэффициент активности: –lgf = 0,502 z2(I)1/2. При разбавлении коэффициент активности увеличивается и при бесконечном разбавлении сильных электролитов ( Концентрацию ионов в сильном электролите можно рассчитать по формуле
где Диссоциация слабых электролитов представляет обратимый процесс, причем равновесие сильно смещено влево СН3СООН «СН3СОО– + Н+. Данное равновесие характеризуется константой равновесия, которая называется константой диссоциации КД и имеет вид:
где В общем виде КД записывается на основании закона действующих масс:
Константа диссоциации указывает на прочность молекул в данном растворе. Чем больше константа диссоциации, тем сильнее диссоциирует электролит, следовательно, менее устойчивы его молекулы. Величина КД зависит от природы электролита, температуры и не зависит от концентрации.
Закон разбавления Оствальда связывает КД и a зависимостью: если степень диссоциации электролита очень мала, то
где с(x) – молярная концентрация электролита, моль/дм3. Равновесие KA «K+ + A– слабых электролитов можно смещать вправо или влево, изменяя концентрацию или температуру, а также изменяя равновесную концентрацию находящихся в растворе ионов. Слабые электролиты – многоосновные кислоты и многокислотные основания диссоциируют обратимо по ступеням, причем диссоциация протекает главным образом по первой ступени, в меньшей мере по второй и в незначительной степени – по третьей. Многоосновные кислоты I ступень
II ступень
Многокислотные основания I ступень
II ступень
Концентрацию ионов моль/дм3 в слабом электролите можно рассчитать по формуле
Слабые электролиты диссоциируют ступенчато, следовательно, n = 1. Реакции в растворах электролитов протекают между ионами и направлены в сторону образования легколетучих, нерастворимых, слабодиссоциирующих и комплексных соединений. При составлении ионно-молекулярных соединений формулу записывают в таком виде, в каком находится в растворе большая часть всего вещества, т. е. формулу слабых электролитов, труднорастворимых и газообразных соединений записывают в молекулярном виде, сильных растворимых электролитов – в ионном. Например: AlCl3 + 3NaOH = Al(OH)3¯ + 3NaCl, Al3+ + 3Cl– + 3Na+ + 3OH– = Al(OH)3¯ + 3Na+ + 3Cl–. Исключив ионы, не участвующие в реакции, получим сокращенное ионно-молекулярное уравнение Al3+ + 3OH– = Al(OH)3¯.
|
|||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 173; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.22.135 (0.009 с.) |
 ) связана с
) связана с 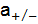 ) формулой:
) формулой: , (9.1)
, (9.1)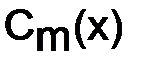 z2, (9.2)
z2, (9.2) – моляльная концентрация иона, моль/кг; z – его заряд.
– моляльная концентрация иона, моль/кг; z – его заряд. ) a» с.
) a» с. , (9.3)
, (9.3) – число ионов данного вида;
– число ионов данного вида;  – степень диссоциации;
– степень диссоциации;  – молярная концентрация электролита, моль/дм3.
– молярная концентрация электролита, моль/дм3. ,
, ,
,  – концентрация ионов, моль/дм3;
– концентрация ионов, моль/дм3;  – концентрация молекул кислоты, моль/дм3.
– концентрация молекул кислоты, моль/дм3.

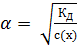 , (9.4)
, (9.4)
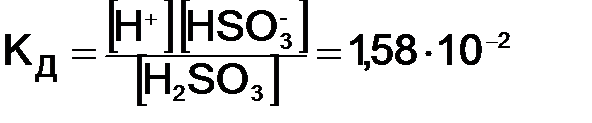 ;
;
 .
.
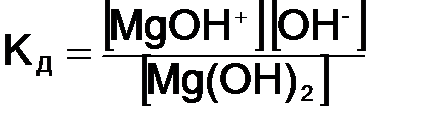 ;
;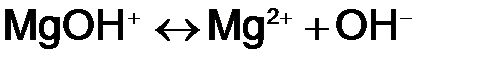
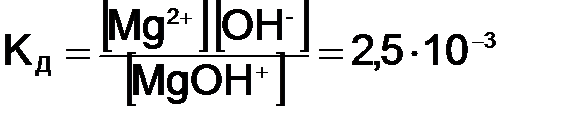 .
.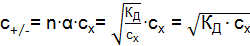 . (9.5)
. (9.5)


