
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы выражения концентрации растворов
Теоретические сведения
Растворы – однородные (гомогенные) системы переменного состава, состоящие из растворённого вещества, растворителя и продуктов их взаимодействия. Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы, называется концентрацией. Известны несколько способов выражения концентрации [2]. Массовая доля ω – отношение массы m(x) растворенного вещества к массе раствора m (р-ра):
если известны плотность r и объем раствора
Массовая доля показывает содержание растворенного вещества как часть единицы, причем за единицу принимается масса всего раствора. Наиболее часто всю массу раствора принимают за 100 %, и тогда концентрацию растворенного вещества выражают в масс, %. Для перевода массовой доли растворенного вещества, %, величину w умножают на 100. Процентная концентрация (масс.%) показывает число граммов растворенного вещества на 100 г раствора. Молярная концентрация с(х), моль/
где Таким образом, молярная концентрация показывает число молей растворенного вещества на 1 л раствора. Молярная концентрация эквивалента вещества
где Моляльная концентрация
Следовательно, моляльная концентрация, это число молей растворенного вещества на 1 кг растворителя. Этот способ выражения концентрации используется реже, чем молярная концентрация.
Титр раствора вещества
Концентрация растворов определяется разными способами: · по плотности раствора – с помощью ареометра; · методом титрования; · по оптической плоскости (фотоколориметрически) и другими методами.
Примеры решения задач
Задача 1. Определить молярную концентрацию эквивалента кислоты, содержащего 9,8 г H3PO4 в 2 Решение. Находим молярную массу эквивалента кислоты в граммах:
Используя формулу (8.4), рассчитаем молярную концентрацию эквивалента кислоты:
Задача 2. Определить титр, г/см3, раствора гашеной извести с молярной концентрацией гидроксида кальция 0,01 моль/дм3. Решение. Из формулы (8.3) найдем массу гидроксида кальция:
Из формулы (8.6) найдем титр
Задача 3. Вычислить массу хлорида натрия, необходимую для приготовления 10%-ного раствора в воде объемом 270 см3. Решение. Массу
Откуда Так как
тогда
8.3. Индивидуальные задания
211. Какова должна быть массовая доля хлороводорода в соляной кислоте, чтобы в ней на 10 моль приходился 1 моль хлороводорода? 212. Определите молярную концентрацию раствора KOH, в котором массовая доля KOH составляет 8 % (ρ = 1,064 213. Слили 325 г раствора азотной кислоты с массовой долей 30 % и 125 г раствора азотной кислоты с массовой долей 60 %. Определить массовую долю азотной кислоты в новом растворе. 214. Из раствора соли (ω = 16 %) массой 640 г выпарили воду массой 160 г и при этом из раствора выпал осадок массой 8 г. Вычислите содержание соли в растворе в массовых долях. 215. Какова будет массовая доля азотной кислоты в растворе, если к 40 мл 96%-ного раствора 216. Определите массовую долю (ω, %) растворенного вещества в 217. Как приготовить 300 г 2%-ного раствора сульфата цинка из 218. Определите массовую долю (ω, %) растворенного вещества в 10-нормальном растворе
219. Как из 2,00 молярного раствора соды приготовить 0,25-нормальный раствор? 220. Определите молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция плотностью 1,178 221. Какой объем 10%-ного раствора карбоната натрия с плотностью 1,105 222. Определите массовую долю (ω, %) растворенного вещества в 15-нормальном растворе 223. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н раствора серной кислоты прибавить 125 см3 0,2 н раствора KOH? 224. В производстве аммиачной селитры применяется раствор с массовой долей азотной кислоты 60 %. Выразите молярную концентрацию этого раствора, если ρ = 1,373 225. При растворении серной кислоты массой 66,8 г в воде массой 133,2 г получили раствор (ρ = 1,25 226. Титр раствора 227. Чему равна молярная концентрация эквивалента раствора NaOH с массовой долей 30 % (ρ = 1,328 228. Какой объем раствора серной кислоты с массовой долей 90 % 229. На нейтрализацию 60 см3 0,24 н раствора серной кислоты израсходовано 180 см3 раствора KOH. Рассчитайте молярную концентрацию эквивалента раствора KOH. 230. Вычислить массу поваренной соли, необходимой для приготовления раствора с массовой долей NaCl 8 % и с плотностью 1,059 231. К 3 232. Вычислите объем 0,3 нормального раствора соляной кислоты, необходимый для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? 233. Определите массу карбоната калия, содержащуюся в 250 см3 раствора с молярной концентрации эквивалентов 0,2 моль/ 234. На нейтрализацию 60 см3 0,24 н раствора серной кислоты израсходовано 180 см3 раствора KOH. Рассчитайте эквивалентную концентрацию раствора KOH. 235. Определить молярную концентрацию 60%-ного раствора HNO3. Сколько потребуется такого раствора для приготовления 1,5 л 20%-ного раствора 236. Определить молярную и моляльную концентрации 20%-ного раствора KOH. Сколько надо испарить воды, чтобы получить 2 237. Определите процентную концентрацию 0,01 молярного раствора 238. В лаборатории имеется раствор с массовой долей гидроксида натрия 30 %, плотность которого 1,33 г/см3. Какой объем этого раствора надо взять для приготовления раствора объемом 250 см3 с массовой долей гидроксида натрия 14 и плотностью 1,15 г/см3? 239. Из раствора соли (ω = 16 %) массой 640 г выпарили воду массой 160 г и при этом из раствора выпал осадок массой 8 г. Вычислите содержание соли в растворе в массовых долях. 240. Определите массовую долю (ω, %) растворенного вещества в растворах: а) 6М HCl (ρ = 1,100 г/
|
||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 285; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.9.115 (0.02 с.) |
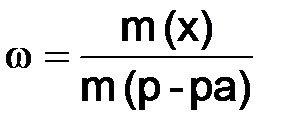 , (8.1)
, (8.1)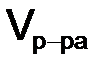 , то:
, то: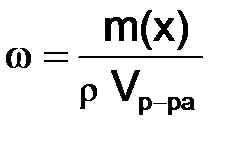 . (8.2)
. (8.2) , или молярность М, – выражается отношением числа моль растворенного вещества к объему раствора в дм3 (л):
, или молярность М, – выражается отношением числа моль растворенного вещества к объему раствора в дм3 (л): , (8.3)
, (8.3)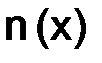 – количество вещества х, моль;
– количество вещества х, моль;  – масса вещества х, г;
– масса вещества х, г;  – молярная масса вещества х, г/моль;
– молярная масса вещества х, г/моль; 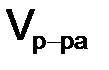 – объем раствора, дм3.
– объем раствора, дм3.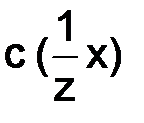 , моль/дм3, или нормальность Н, – выражается отношением моль эквивалентов вещества к объему раствора 1 дм3 (л):
, моль/дм3, или нормальность Н, – выражается отношением моль эквивалентов вещества к объему раствора 1 дм3 (л): , (8.4)
, (8.4) – количество моль эквивалентов вещества х;
– количество моль эквивалентов вещества х; 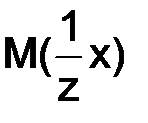 – молярная масса эквивалента вещества х, г/моль; z – число эквивалентности;
– молярная масса эквивалента вещества х, г/моль; z – число эквивалентности; 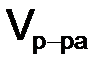 – объем раствора,
– объем раствора, 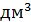 (л).
(л). , моль/кг – отношение количества растворенного вещества, (n (x) моль), к массе растворителя (mР-ЛЯ 1 кг):
, моль/кг – отношение количества растворенного вещества, (n (x) моль), к массе растворителя (mР-ЛЯ 1 кг): . (8.5)
. (8.5)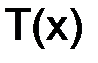 , г/см3, – отношение массы растворенного вещества, г, к объему раствора, см3 (мл):
, г/см3, – отношение массы растворенного вещества, г, к объему раствора, см3 (мл):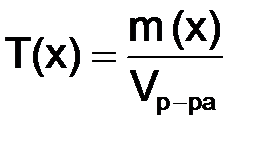 . (8.6)
. (8.6) г/моль.
г/моль.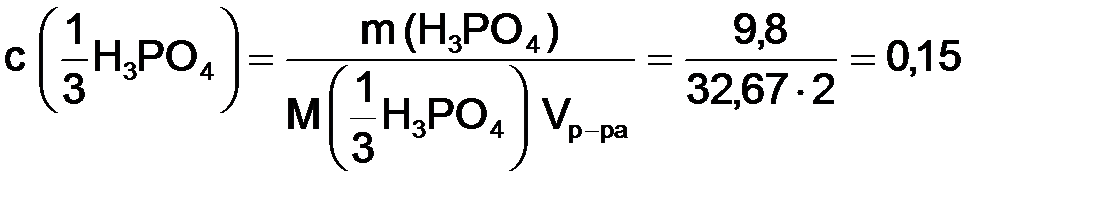 моль/дм3.
моль/дм3. ;
;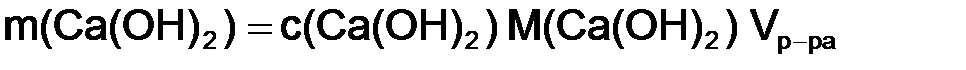 ;
;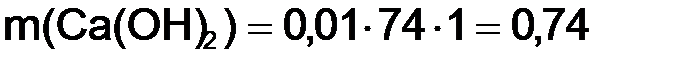 г.
г.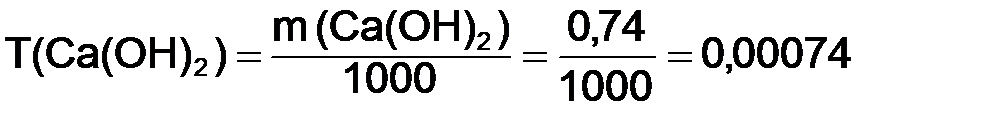 г/см3.
г/см3. вычисляем по формуле (8.1)
вычисляем по формуле (8.1) .
. или
или 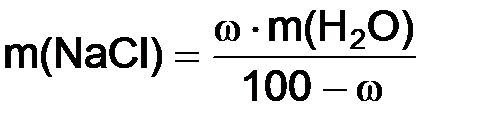 .
.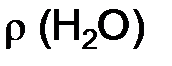 = 1 г/см3 , массу воды находим по формуле
= 1 г/см3 , массу воды находим по формуле ,
,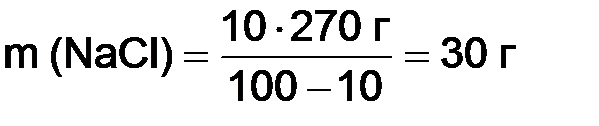 .
. ).
).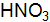 (плотность 1,5
(плотность 1,5 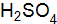 (ρ = 1,289
(ρ = 1,289  потребуется для приготовления 5 л 2%-ного раствора с плотностью 1,02
потребуется для приготовления 5 л 2%-ного раствора с плотностью 1,02  (ρ = 1,289
(ρ = 1,289 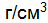 .
.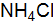 . Сколько надо взять соли, чтобы приготовить 2 л такого раствора?
. Сколько надо взять соли, чтобы приготовить 2 л такого раствора?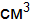 ); б) 10 н
); б) 10 н 


