
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изменение окислительно-восстановительных свойств
элементов и их соединений
Окисление и восстановление – это свойства, связанные со способностью атома принимать или отдавать электроны. Каждый атом стремится образовать устойчивую электронную оболочку, подобную той, которую имеют инертные газы, поэтому металлы отдают свои электроны, так как их на последнем уровне один, два, а не металлы (сера, фосфор, галогены) принимают, потому что до завершения уровня не хватает одного или двух электронов. Атомы, отдающие электроны, окисляются, но в реакциях являются восстановителями, а те атомы, которые принимают – восстанавливаются, но являются окислителями. Определить окислительно-восстановительные свойства атомов можно по значению электроотрицательности. В главных подгруппах сверху вниз электроотрицательность уменьшается, что приводит к уменьшению окислительных и увеличению восстановительных свойств. В периодах слева направо электроотрицательность возрастает. Таким образом, сильные восстановители располагаются в левом нижнем углу периодической системы элементов (калий, рубидий, цезий, барий), в то время как сильные окислители находятся в правом верхнем ее углу (кислород, фтор, хлор). Примеры решения задач Пример 1. У какого из двух элементов, марганца или брома, сильнее выражены металлические свойства? Решение. Данные элементы находятся в четвертом периоде. Записываем их электронные формулы: 25 Mn 35 Br Марганец – d-элемент, т. е. элемент побочной подгруппы, а бром – Общей закономерностью для всех групп, содержащих р- и d-элементы является преобладание металлических свойств у d-элементов, ОЭО Mn = 1,5, Br = 2,8. Таким образом, у марганца металлические свойства выражены сильнее, чем у брома. 3.3. Индивидуальные задания 61. У атомов какого из элементов – хрома Сr или селена Sе – в большей степени выражены металлические свойства? При взаимодействии атомов хрома и селена какой из них проявляет восстановительные свойства?
62. Какая кислота является более сильной – 63. Может ли и почему азот быть окислителем по отношению к хлору? Ответ пояснить. 64. Напишите электронные конфигурации ионов 65. Напишите краткую электронную конфигурацию атомов кремния Si и свинца Pb. Являются ли они аналогами электронной структуры и какие свойства проявляют? 66. Напишите электронные конфигурации ионов 67. Какой из атомов – хлор или йод – является окислителем при образовании молекулы IСl из атомов? У какого из этих атомов, сильнее выражена способность притягивать к себе электроны? 68. На основании электронного строения атома брома Вr определите число электронов, которые могут принимать участие в процессе окисления и восстановления этого атома. Приведите примеры атомов элементов VА – подгруппы окислителей и восстановителей по отношению к брому. 69. Запишите электронную конфигурацию двухзарядного отрицательного иона селена 70. Запишите электронную конфигурацию двухзарядного положительного иона марганца 71. Увеличиваются или уменьшаются значения энергии сродства 72. Укажите номер подгруппы атомов элементов, у которых электронная конфигурация внешнего уровня и незавершенного предвнешнего подуровня 73. Перечислите элементы, атомы которых завершают формирование К- и L-оболочек. К какой подгруппе и почему относятся эти элементы? 74. Назовите элемент, атомы которого на энергетическом уровне с 75. Объясните, какая из двух электронных конфигураций атома бора В: первая –
76. Почему в VII группе ПСЭ объединены атомы элементов неметаллов – галогенов (А-подгруппа) и атомы элементов с характерными металлическими свойствами (В-подгруппа)? 77. У атомов элементов IВ-подгруппы (Си, Аg, Аu) наблюдается явление «провала» электрона. Запишите общую сокращенную электронную формулу атомов этих элементов без «провала» и с «провалом» электрона; чем обусловлен этот эффект? 78. Что понимают под процессом ионизации данного атома? Затрачивается или поглощается энергия при образовании положительных ионов? Приведите примеры. 79. Почему атомы типичных металлов (приведите примеры) обладают малыми значениями первой энергии ионизации? 80. Атомы какого из элементов VIIА-подгруппы в большей степени проявляют восстановительные свойства по отношению к фтору? 81. Магний или алюминий является более сильным восстановителем? Соответствует ли это большему значению первой энергии ионизации магния (7,6 Эв) по сравнению с алюминием (6,0 эВ). 82. Объясните, у какого элемента – Ва или Са – сильнее выражены металлические свойства. Каков характер оксидов, с какими веществами могут вступать в реакции? Приведите примеры реакций. 83. Объясните, у какого элемента – Cr или Se – сильнее выражены металлические свойства. Какой характер у оксидов и гидроксидов в зависимости от степени окисления этих элементов. 84. Расположите элементы в порядке возрастания их неметаллических свойств: олово, кислород, сера, теллур, селен. Ответ поясните. 85. Расположите оксиды в порядке возрастания их кислотных свойств: 86. Какие элементы называются электронными аналогами? Перечислите электронные аналоги в шестой группе периодической системы элементов. Какой общей электронной формулой можно описать конфигурацию внешнего электронного слоя халькогенов? 87. Почему марганец проявляет металлические свойства, а хлор – неметаллические? Ответ мотивируйте строением атомов этих элементов. Запишите их электронные формулы. Приведите реакции, доказывающие их свойства. 88. У какого из р-элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Ответ обоснуйте исходя из строения атомов данных элементов. Запишите их электронные формулы. 89. Определите место элемента в периодической системе и основные химические свойства по порядковому номеру 17, 24, 19. Запишите необходимые реакции. 90. Покажите, как периодический закон иллюстрирует и подтверждает один из всеобщих законов развития природы – закон перехода количества в качество.
ХИМИЧЕСКАЯ СВЯЗЬ Теоретические сведения Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное. У атомов на внешнем энергетическом уровне может быть от одного до восьми электронов. Если на внешнем уровне содержится максимальное число электронов, которое он может вместить, то такой уровень называют завершенным. Завершенные уровни характеризуются большой прочностью. Такие уровни имеют атомы благородных газов. Атомы других элементов имеют незавершенные энергетические уровни и в процессе химического взаимодействия завершают их.
Химическая связь – это совокупность сил, действующих между атомами или группой атомов. Химическая связь осуществляется валентными электронами. По современным представлениям химическая связь имеет электронную природу, но осуществляется она по-разному. Поэтому различают три основных типа химической связи: ковалентную, ионную, металлическую. Между молекулами возникает водородная связь, и происходят вандерваальсовые взаимодействия. К основным характеристикам химической связи, относятся: · длина связи – это межъядерное расстояние между химически связанными атомами. Она зависит от природы взаимодействующих атомов и от кратности связи. С увеличением кратности длина связи уменьшается, следовательно, увеличивается ее прочность; · кратность связи – определяется числом электронных пар, связывающих два атома. С увеличением кратности энергия связи возрастает; · угол связи – угол между воображаемыми прямыми проходящими через ядра двух химически взаимосвязанных соседних атомов; · энергия связи ЕСВ – это энергия, которая выделяется при образовании данной связи и затрачивается на ее разрыв (кДж/моль) [1].
Ковалентная связь Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной Объяснение химической связи возникновением общих электронных пар между атомами легло в основу спиновой теории валентности, инструментом которой является метод валентных связей (МВС), открытый Льюисом в 1916 г. Основные принципы образования химической связи по МВС 1. Химическая связь образуется за счет валентных (неспаренных) электронов. 2. Электроны с антипараллельными спинами, принадлежащие двум различным атомам, становятся общими. 3. Химическая связь образуется только в том случае, если при сближении двух и более атомов полная энергия системы понижается. 4. Основные силы, действующие в молекуле, имеют электрическое, кулоновское происхождение. 5. Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Механизмы образования ковалентной связи: а) обменный механизм. Связь образована путем обобществления валентных электронов двух нейтральных атомов. Каждый атом дает по одному неспаренному электрону в общую электронную пару (рис. 4.1);
Рис. 4.1. Обменный механизм образования ковалентной связи: а – не полярной; б – полярной
б) донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь (рис. 4.2). Соединения, образованные по донорно-акцепторному механизму, относятся к комплексным соединениям.
донор акцептор
Рис. 4.2. Донорно-акцепторный механизм образования ковалентной связи Характеристики ковалентной связи: насыщаемость – свойство атомов образовывать строго определенное число ковалентных связей. Благодаря насыщаемости связей молекулы имеют определенный состав;
σ -связь –образована перекрыванием АО по линии, соединяющей центры взаимодействующих атомов; π -связь – это связь, возникающая в направлении оси перпендикулярной прямой, соединяющей ядра атома. Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрическую форму. Гибридизация – это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Химическая связь, образуемая с участием электронов гибридных орбиталей, более прочная, чем связь с участием электронов негибридных s- и р-орбиталей, так как происходит большее перекрывание. Различают следующие виды гибридизации (рис. 4.4): ● sp-гибридизация – одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию BeCl2; ● sp2гибридизация – одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°. Молекулы, в которых осуществляется sp2-гибридизация, имеют плоскую геометрию (BF3, AlCl3); ● sp3гибридизация – одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109°28'. Молекулы, в которых осуществляется sp3-гибридиза-ция, имеют тетраэдрическую геометрию (CH4,NH3). Полярность – это распределение электронной плотности между двумя атомами. Если электронная плотность расположена симметрично между атомами, то ковалентная связь называется неполярной ( Eсли в образовании связи участвуют разные атомы, то электронная плотность смещеается в сторону более электроотрицательного атома (см. табл. 3.5) и ковалентная связь называется полярной (
Полярность связи тем больше, чем больше разность электроотрицательностей атомов, молекула называется диполем. Диполь –это система, в которой имеется два электрических заряда, равных по величине, но противоположных по знаку, расположенных на некотором расстоянии друг от друга.
в
Рис. 4.4. Виды гибридизаций валентных орбиталей: а –sp-гибридизация валентных орбиталей; б – sp2-гибридизация валентных орбиталей; в – sp3-гибридизация валентных орбиталей [2]
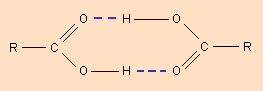
Произведение длины диполя l, т.е. расстояния между полюсами в молекуле, на величину заряда электрона qē, абсолютное значение заряда электрона
Дипольный момент молекулы служит количественной мерой ее полярности. Дипольные моменты молекул измеряют в дебаях D. 1D = Дипольный момент направлен от положительного конца диполя к отрицательному. Поэтому дипольный момент многоатомной молекулы следует рассматривать как векторную сумму дипольных моментов связей: он зависит не только от полярности каждой связи, ни и от взаимного расположения этих связей. Поляризуемость – способность молекулы становиться полярной. Данное явление происходит под действием внешнего электрического поля или под влиянием другой молекулы, являющейся партнером по реакции. Существует обратная зависимость между полярностью и поляризуемостью ковалентной связи: чем больше полярность связи, тем меньше остается возможности для их дальнейшего смещения под действием внешних сил. Ионная связь Ионная (электровалентная) связь – это сильнополярная ковалентная связь. В ее основе лежит электростатическое взаимодействие ионов. Согласно ей атомы элементов с числом электронов в наружном слое меньше восьми присоединяют или теряют такое число электронов, которое делает наружный электронный слой таким, как у атома ближайшего инертного газа. Атом, потерявший электроны, превращается в положительно заряженный ион (катион). Атом, присоединивший электроны, становится отрицательно заряженным ионом (анион). Разноименно заряженные ионы притягиваются друг к другу (рис. 4.5).
Рис. 4.5. Схема образования хлорида натрия из простых веществ
Возникновение ионной связи имеет место только в том случае, если элементы, атомы которых реагируют между собой, обладают резко отличными значениями энергии ионизации и сродства к электрону. Ионных соединений немного. Они обладают основными свойствами: в расплавленном состоянии обладают электропроводностью, в воде легко диссоциируют на ионы (растворяются), имеют высокую температуру плавления и кипения. Ионная связь характеризуется следующими показателями. Ненаправленность. Ионы – заряженные шары, их силовые поля равномерно распределяются во всех направлениях в пространстве, поэтому они притягивают противоположный по знаку ион в любом направлении. Ненасыщаемость. Взаимодействие двух ионов не может привести к полной взаимной компенсации их силового поля. Поэтому у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Ионный кристалл ( Металлическая связь Металлическая связь основана на обобществлении валентных электронов, принадлежащих не двум, а практически всем атомам металла в кристалле. В металлах валентных электронов намного меньше, чем свободных орбиталей. Это создает условия для свободного перемещения электронов по орбиталям разных атомов металла. Внутри металла происходит непрерывное хаотичное движение электронов от атома к атому, В молекулах, образованных более чем двумя атомами различных элементов, могут существовать разные типы связей. Водородная связь
Водородная связь – одна из разновидностей взаимодействия между полярными молекулами, бывает внутри- и межмолекулярной (рис. 4.6). Она образуется между электроотрицательными атомами одной молекулы и атомами водорода другой, типа Н–Х (Х – это F, O, N, Cl, Br, I) за счет сил электростатического притяжения. Связь между водородом и одним из этих атомов характеризуется достаточной полярностью, поскольку связующее электронное облако смещено в сторону более электроотрицательного атома. Водород в данном случае расположен на положительном конце диполя. Два и более таких диполя взаимодействуют между собой так: ядро атома водорода одной молекулы (положительный конец диполя) притягивается неподеленной электронной парой второй молекулы. Данная связь проявляется в газах, жидкостях и твердых телах. Она относительно прочна. Понижение температуры способствует образованию водородной связи. Наличие водородной связи обусловливает повышение устойчивости молекул вещества, а также повышению их температуры кипения и плавления. Образование водородных связей играет важную роль как в химических, так и в биологических системах. Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 4.6, б).
Рис. 4.6. Образование водородной связи: а – внутримолекулярной,
Существование веществ в различных агрегатных состояниях свидетельствует о том, что между частицами (атомы, ионы, молекулы) имеет место взаимодействие, обусловленное ван-дер-ваальсовыми силами притяжения. Наиболее важной и отличительной чертой этих сил является их универсальность, так как они действуют без исключения между всеми атомами и молекулами. Межмолекулярные силы (силы ван-дер-ваальса) –взаимодействие между молекулами, в результате которого вещество переходит в жидкое или твердое состояние. Межмолекулярные силы имеют электрическую природу. Они обусловлены полярностью и поляризуемостью молекул. Различают три типа межмолекулярного взаимодействия: дипольное, индукционное, дисперсионное. Примеры решения задач
Пример 1. Длина димоля молекулы HCl равна Решение. Для расчета используем формулу:
4.3. Индивидуальные задания 91. Объясните, что определяет межъядерное расстояние. Почему при сближении атомов их ядра не сливаются? 92. Изобразите все возможные способы перекрывания s-орбитали с р-орбиталью; двух р-орбиталей. Укажите направленность связи при этом, а также обозначьте δ- и π-связи. 93. Почему использование гибридных орбиталей предпочтительнее, чем обычных (негибритизованных) при образовании химической связи? Приведите примеры молекул, которые при образовании связи используют гибридные орабитали. 94. Чем отличается ионная связь от ковалентной? Приведите примеры соединений с такими связями. 95. Предскажите геометрию молекул CF4, SiH4, PH3. 96. Объясните донорно-акцепторный механизм ковалентной связи на примере образования иона фосфония [РН4]+. 97. Какие из двух элементов образуют соединения с преобладанием ионной или ковалентной связей: а) рубидий с фтором; б) водород с фтором; в) водород с углеродом? 98. Почему Н2О и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги? 99. Почему в галогенидах щелочных металлов формируется ионная связь? 100. Объясните причины и приведите примеры сходства и отличия ионной связи от ковалентной связи. Приведите примеры веществ с ионной и ковалентной связями. 101. Ковалентный или ионный тип связи характерен для следующих соединений: NaJ, SO2, KF, CO2? 102. Почему при растворении HCl в воде образуются ионы, хотя связь в молекуле не ионная? 103. Почему ионная связь считается предельным случаем ковалентной? 104. Как влияет водородная связь на температуру кипения и плавления? 105. Какие электроны атома бора участвуют в образовании ковалентных связей? Как метод валентных связей объясняет симметричную треугольную форму молекулы ВF3? 106. Какую химическую связь называют ионной? Как она образуется и какими свойствами обладает? На основе разности относительных электроотрицательностей атомов элементов укажите, как изменяется степень ионности в соединениях HF, HCl, HBr, HI. 107. Приведите примеры образования ковалентной связи по донорно-акцепторному механизму. 108. Почему молекула диоксида углерода неполярна, хотя связь углерод–кислород имеет электрический момент диполя 109. Молекула BF3 имеет плоскостную структуру, а NF3 – объемную (пирамидальную). В чем причина различия в строении молекул? 110. Как влияет водородная связь на температуру кипения и плавления? 111. Какая химическая связь называется ионной? Чем определяется величина положительной валентности элементов, участвующих в образовании ионной связи? 112. В чем сходство и отличие водородной связи от других видов связи? Приведите примеры веществ с водородной связью. 113. Почему в металлах химическая связь делокализована? 114. Что называют электрическим моментом диполя? Какая из молекул HCl, HBr, HJ имеет наибольший момент диполя? Почему? 115. Как метод валентных связей (ВС) объясняет линейное строение молекулы BeCl2 и тетраэдрическое СН4? 116. Исходя из значений электроотрицательности атомов соответствующих элементов, определите, какая из связей – HCl, JCl, BrF – наиболее полярна. 117. Какую ковалентную связь называют d-, p-, s-связью? Как метод ВС объясняет строение молекулы азота? 118. Охарактеризуйте силы ван-дер-ваальса. Какое взаимодействие молекул называют ориентационным, индукционным, дисперсионным? 119. Что называется поляризацией? Какие бывают виды поляризации? Чем определяется поляризация атомов, ионов? Как меняются свойства соединений в зависимости от поляризации? 120. Что называется диполем, дипольным моментом? Что характеризует величина дипольного момента? В ряду HCl, HBr, HI электрические моменты диполей молекул равны
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 571; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.119.251 (0.113 с.) |
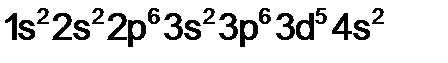 ;
; .
. ? Как называются соли этих кислот? Запишите реакции получения солей данных кислот.
? Как называются соли этих кислот? Запишите реакции получения солей данных кислот. Почему атомы элементов бария и лантана являются сильными восстановителями?
Почему атомы элементов бария и лантана являются сильными восстановителями?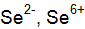 . Почему для селена характерны как окислительные, так и восстановительные свойства? Приведите примеры.
. Почему для селена характерны как окислительные, так и восстановительные свойства? Приведите примеры. . Изменяется ли и как радиус отрицательного иона селена по сравнению с нейтральным атомом селена?
. Изменяется ли и как радиус отрицательного иона селена по сравнению с нейтральным атомом селена? и четырехзарядного
и четырехзарядного 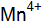 . Как соотносятся энергии ионизации у этих ионов и их ионные радиусы?
. Как соотносятся энергии ионизации у этих ионов и их ионные радиусы?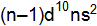 . Приведите электронные формулы элементов.
. Приведите электронные формулы элементов.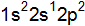 или вторая –
или вторая – 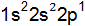 соответствует основному состоянию. Покажите графически распределение электронов по атомным орбиталям в нормальном и возбужденном состояних. Какую валентность имеет бор в этих состояниях?
соответствует основному состоянию. Покажите графически распределение электронов по атомным орбиталям в нормальном и возбужденном состояних. Какую валентность имеет бор в этих состояниях?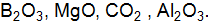 Ответ поясните. Запишите реакции доказывающие характер оксидов.
Ответ поясните. Запишите реакции доказывающие характер оксидов. Рис. 4.3. Схема образования связей в молекуле N2: а – σ-связей; б – π-связей
Рис. 4.3. Схема образования связей в молекуле N2: а – σ-связей; б – π-связей
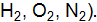
 , HCl).
, HCl).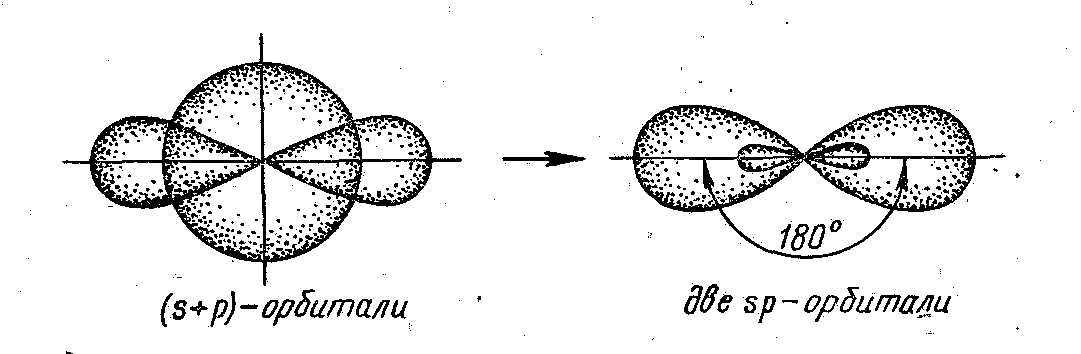


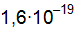 Кл, называется дипольным моментом μ.
Кл, называется дипольным моментом μ. .
. Кл·м. Чем больше длина диполя (дипольный момент), тем больше полярность молекулы (
Кл·м. Чем больше длина диполя (дипольный момент), тем больше полярность молекулы ( , и др.).
, и др.).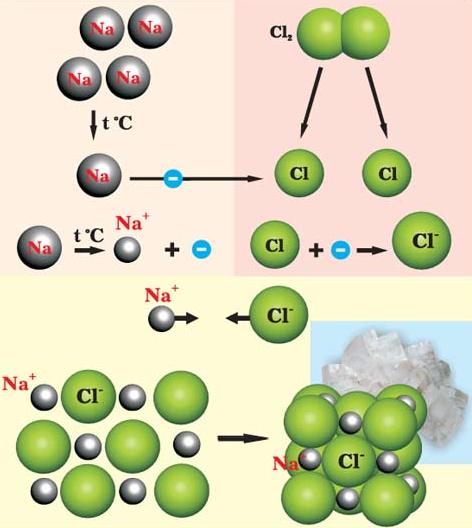
 ) – это структура, состоящая из ионов.
) – это структура, состоящая из ионов. 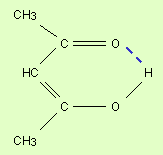
 см. Вычислите электрический момент диполя.
см. Вычислите электрический момент диполя.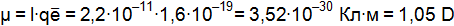
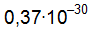 Кл×м?
Кл×м? Кл×м.
Кл×м. 


