
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронные формулы элементов
Запись, отражающая распределение электронов в атоме химического элемента по энергетическим уровням и подуровням, называется электронной конфигурацией этого атома. Пример. Цезий Сs находится в 6-м периоде, его 55 электронов (порядковый номер 55) распределены по 6 энергетическим уровням и их подуровням, соблюдая последовательность заполнения электронами орбиталей получим: 55Cs 1s2 2s2 2p6 3s2 3p6 4s2 4p6 4d10 5s2 5p6 5d10 6s1. В свою очередь электронная конфигурация лития – 3Li 1s22s1; углерода – 6C 1s22s22p2, хлора – 1 7 Cl 1s22s22p63s23p5. Примеры решения задач Пример 1. Последним электронную оболочку некоторого элемента заселяет электрон с набором квантовых чисел: n = 3, l = 2, m = –2,
Расположив на ней единственный электрон (стрелка вверх, так как s = +1/2) и зная, что он последний, мы приходим к выводу, что остальные d-орбитали пусты. Теперь мы уже можем записать сокращенную электронную формулу элемента …3d1. Этот элемент легко найти в периодической таблице – это скандий 21Sc. Всего на орбитальной диаграмме элемента поместится ровно 21 электрон, следовательно, в его ядре 21 протон и его порядковый номер в таблице Менделеева тоже 21 (Sc). Орбитальная диаграмма помогает записать и полную электронную формулу для скандия:
Пример 2. Элемент имеет порядковый номер 18. Напишите полную электронную формулу, указав, на каких энергетических уровнях и подуровнях находятся электроны в атомах этого элемента. Решение. Заполнение электронами энергетических уровней и подуровней происходит в порядке возрастания энергии: 1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 4f ≈ ≈ 5d < 6p < 7s ≈ 5f ≈ 6d < 7p. Порядковый номер 18, т.е. атом содержит 18 электронов, так как находится в третьем периоде – у него 3 энергетических уровня и его электронная формула имеет вид: Пример 3. Сокращенная электронная формула элемента изображена в виде
Решение. Судя по строению электронной оболочки, элемент находится в 4-м периоде, валентные электроны (3d3 + 4s2), т.е. общее число 5, следовательно, в V группе, d-орбиталь не завершенна я, это d-элемент, пятой группы, побочной подгруппы. Электронная формула этого элемента
Пример 4. Составьте электронные и электронно-графические формулы атомов элементов с порядковыми номерами 16 и 22. Решение. Число электронов в атоме элемента равно его порядковому номеру в таблице Д. И. Менделеева. Если элемент с порядковым номером 16 – это сера, а с номером 22 – титан. Сера находится в 3-м периоде, следовательно, у нее 3 энергетических уровня и на последнем уровне для серы – для титана – Электронно-графические формулы этих атомов: для 16S:
для 22Ti:
2.3. Индивидуальные задания 31. Сокращенная электронная формула элемента изображена в виде: а)...6p3; б)…3s23p2; в) … 4s24р1. Какой это элемент? Напишите полную электронную формулу и набор квантовых чисел для «последнего» электрона на внешнем электронном уровне*. 32. Сокращенная электронная формула элемента изображена в виде:...3d6. Какой это элемент? Напишите полную электронную формулу и набор квантовых чисел для 6-го электрона на d-подуровне*. 33. Напишите полную электронную формулу элемента неодима 60Nd. К какому электронному семейству относится данный элемент? 34. Напишите полную электронную формулу и графически изобразите распределение электронов по орбиталям для элемента 20Са. Запишите набор квантовых чисел для последнего (наиболее далекого от ядра) электрона этого элемента*. 35. В каком элементе при его образовании из субатомных частиц последним свое место в электронной оболочке займет электрон с таким набором квантовых чисел: n = 3, l = 2, m = 0, s = 1/2? Напишите полную электронную формулу для этого элемента*. 36. Для какого элемента «последним» в электронной оболочке будет электрон с таким набором квантовых чисел: n = 3, l = 1, m = –1, s = 1/2? Напишите полную электронную формулу для этого элемента. Сколько у него неспаренных электронов?*
37. Для какого элемента «последним» в электронной оболочке будет электрон с таким набором квантовых чисел: n = 2, l = 1, m = 0, s = –1/2? Напишите полную электронную формулу*. Почему этот элемент не может быть благородным? Какой подуровень не заполнен по сравнению с ближайшим благородным элементом? Какой благородный элемент ближайший по электронному строению? 38. Назовите элементы и укажите число неспаренных электронов в атомах, имеющих следующие электронные конфигурации: а) 1s2 2s2 2p6 3s2 3p2; б) 1s2 2s2 2p6 3s2 3p6 3d64s2; в) 1s2 2s2 2p6 3s2 3p6 3d104s2 4р3. 39. Объясните принципы и правила, определяющие последовательность заполнения атомных орбиталей электронами. Напишите электронную формулу элемента с порядковым номером: а) 13; б) 20; в) 51. 40. Что характеризуют квантовые числа? Каково соотношение между ними? Комбинация каких атомных орбиталей, и в каком количестве возможна для главного квантового числа равного: а) 4; б) 3; в) 2? 41. Что понимают под возбужденным состоянием атома? Напишите электронные формулы атома фосфора, находящегося в нормальном и возбужденном состояниях. Представьте графические электронные формулы для этих двух состояний. 42. Как зависит энергия электрона от орбитального квантового числа в многоэлектронном атоме при постоянном значении главного квантового числа? Какой из подуровней – 3d или 4s – будет заполняться электронами раньше? 43. Определите последовательность заполнения электронных подуровней, если l + n = 5. Что понимают под атомной орбиталью? 44. Напишите электронные формулы атомов элементов с порядковым номером: а) 10, 15, 35; б) 6, 21, 36; в) 19, 22, 34. Какой смысл вкладывают в понятие s-, p-, d-электронных облаков? Как изобразить их графически? 45. Приведите графическую электронную формулу атома: а) железа; б) кобальта; в) никеля. Как располагаются d-электроны в атоме железа? Объясните порядок заполнения d-орбиталей. 46. Какую информацию дает электронная формула элемента? Запишите электронную формулу и представьте графическую формулу валентных электронов элементов: а) хрома; б) молибдена; в) азота. Определите основные химические свойства этих элементов. 47. Какие элементы называются электронными аналогами? Перечислите электронные аналоги в шестой группе периодической системы элементов. Какой общей электронной формулой можно описать конфигурацию внешнего электронного слоя халькогенов? 48. Объясните исходя из электронного строения атомов, каков физический смысл номера периода и номера группы. Напишите электронные формулы атомов следующих элементов: а) калия; б) ванадия; 49. Что понимают под атомным радиусом? Как изменяются атомные радиусы элементов в периодах и группах? Напишите электронные формулы атомов элементов с порядковым номером 19, 22, 34. 50. Какое максимальное число электронов могут занимать s-, p-, d-, 51. Какие орбитали атома заполняются электронами раньше: 4S или 3d? Ответ пояснить примерами. 52. Какие орбитали атома заполняются электронами раньше: 5S или 4р? Ответ поясните примерами.
53. Напишите электронные формулы элементов с порядковыми номерами: а) 9, 38; б) 42, 20; в) 6, 29. Укажите валентные электроны. 54. Напишите электронные формулы атомов элементов с порядковым номером 14 и 40. Сколько свободных 3d-орбиталей у атомов последнего элемента? 55. Напишите электронные формулы атомов элементов с порядковыми номерами: а) 9 и 18; б) 16 и 26; в) 25 и 34. Покажите распределение элементов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? 56. Квантовые числа для электронов внешнего энергетического уровня атомов некоторых элементов имеют следующие значения: n = 4, l = 0, ml = 0, ms = ±½. Напишите электронные формулы атомов этих элементов и определите, сколько свободных 3d-орбиталей содержит каждый из них*. 57. В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- и d12-электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 33 и укажите его валентные электроны. 58. Напишите электронные формулы атомов элементов с порядковым номером 6, 21, 36. Какой смысл вкладывают в понятие s-, p-, 59. Что такое энергия ионизации? В каких единицах измеряется и как меняется значение энергии ионизации по периодам и группам? Напишите электронные формулы атомов элементов с порядковым номером 11, 25, 54. 60. В чем состоит смысл правила Клечковского? Почему оно действует для многоэлектронных атомов? Напишите электронные формулы атомов элементов с порядковыми номерами 26 и 35.
ПЕРИОДИЧЕСКИЙ ЗАКОН. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА Теоретические сведения Исследуя изменение химических свойств элементов в зависимости от величины их относительной атомной массы (атомный вес), Д.И. Менделеев в 1869 г. открыл закон периодичности этих свойств: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомных весов элементов». Поскольку химические свойства обусловлены строением электронных оболочек атома, периодическая система Современная формулировка периодического закона гласит: «Свойства элементов и соединений находятся в периодической зависимости от зарядов атомных ядер».
Это обстоятельство отражено в периодической системе в виде горизонтальных и вертикальных рядов – периодов и групп. Период – горизонтальный ряд, имеющий одинаковое число электронных уровней, номер периода совпадает со значением главного квантового числа nвнешнего уровня (слоя); таких периодов в периодической системе семь. Второй и последующие периоды начинаются щелочным элементом ns1 и заканчивается благородным газом ns2np6. По вертикали периодическая система подразделяется на восемь групп, которые делятся на главные – А-подгруппы, состоящие из s - и p - элементов, и побочные – B-подгруппы, содержащие d-элементы. Подгруппа III B, кроме d-элементов, содержит по 14 4f- и 5f-элементов (семейства 4f - лантаноидов и 5f-актиноидов). Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы. В главных подгруппах валентные электроны (электроны, способные образовывать химические связи) расположены на s - и p-орбиталях внешнего энергетического уровня, в побочных – на s-орбиталях внешнего и d-орбиталях предвнешнего слоя. Для f-элементов валентными являются (n – 2)f-, Сходство элементов внутри каждой группы – наиболее важная закономерность в периодической системе. кроме того, следует отметить такую закономерность, как диагональное сходство у пар элементов Li и Mg, Be и Al, B и Si и др. Эта закономерность обусловлена тенденцией смены свойств по вертикали (в группах) и их изменением по горизонтали (в периодах). Структура электронной оболочки атомов элемента изменяется периодически с ростом порядкового номера элемента, с одной и другой стороны, свойства определяются строением электронной оболочки и, следовательно, находятся в периодической зависимости от заряда ядра атома [1, 2].
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 748; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.108.236 (0.021 с.) |
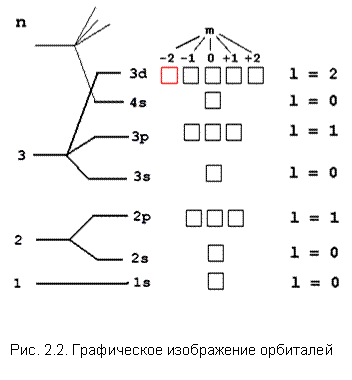 Решение. Данный электрон находится на 3-м уровне (n = 3), причем на d-подуровне (l = 2).
Решение. Данный электрон находится на 3-м уровне (n = 3), причем на d-подуровне (l = 2). 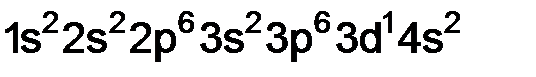 .
.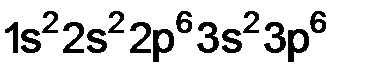 – это аргон.
– это аргон. . Какой это элемент? Напишите его полную электронную формулу и определите, к какому электронному семейству относится данный элемент.
. Какой это элемент? Напишите его полную электронную формулу и определите, к какому электронному семейству относится данный элемент.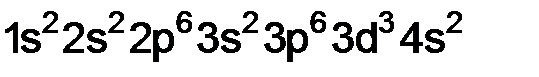 , это
, это 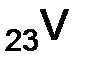 – ванадий.
– ванадий.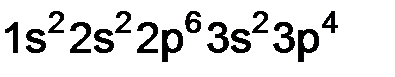 ;
; .
.


