
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Эквивалент. Закон эквивалентов
Эквивалент Э – это реальная или условная частица вещества, которая может присоединять, замещать, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях. При определении эквивалента вещества необходимо исходить из конкретной реакции. Пример: из уравнения реакции Моль эквивалентов – количество вещества, содержащего 6,022 × 1023 эквивалентов. Масса одного моля эквивалентов вещества (элемента) называют молярной массой эквивалентов вещества Пример: Число, обозначающее какая доля от реальной частицы эквивалентно одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях, называют фактором эквивалентности fэ. Пример: врассмотренных примерах: fэ( Закон эквивалентов (И.В. Рихтер, 1809 г.). Химические элементы или вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам:
где Если одно из веществ или оба вещества, вступивших или получившихся в результате реакции, находятся в газообразном состоянии, закон эквивалентов принимает вид:
где Молярный объем эквивалента вещества Поскольку 1 моль любого газа при нормальных условиях занимает объем 22,4 л, то молярный объем эквивалента газообразного водорода будет равняться 11,2 л/моль, а кислорода – 5,6 л/моль. Молярная масса эквивалентов элемента, г/моль, в соединении не является величиной постоянной. Она зависит от валентности элемента, г/моль, в данном соединении и выражается уравнением
где Молярные массы эквивалентов сложных веществ, г/моль, рассчитываются по следующим формулам:
где
где
где
где Моксида – молярная масса оксида; Примеры решения задач
Пример 1. Рассчитайте молярную массу эквивалентов серы в соединениях Решение. Расчет ведем по формуле (1.6): а) SO2 – оксид серы, валентность серы в данном соединении равна 4: МЭ(S) = 32/ 4 = 8 г/моль; б) H2SO4 –серная кислота, валентность серы в данном соединении равна 6: МЭ(S) =32/ 6 = 5,33 г/моль; в) H2S – сероводород, валентность серы в данном соединении равна 2: МЭ(S) = 32/ 2 = 16 г/моль. Пример 2. Рассчитайте молярные массы эквивалентов Мэ следующих веществ Решение. Са(ОН)2–гидроксид кальция, основание. Расчет ведем по формуле (1.8):
Так как в молекуле
а двух, n = 2
Так как в кислоте два атома водорода, то в случае замещения одного
Пример 3. При сгорании металла образуется 9,43 г его оксида. Решение. Учитывая, что Пример 4. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 Решение. Молярная масса водорода равная 2 г/моль, при н.у. занимает объем 22,4 л, то объем молярной массы эквивалентов водорода По закону эквивалентов (1.5):
Согласно закону эквивалентов Пример 5. Сколько металла, эквивалентная масса которого Решение. Молярная масса кислорода, равная 32 г/моль, при н.у. занимает объем 22,4 дм3 (л), то объем молярной массы эквивалентов кислорода (8 г/моль) будет 22,4: 4 = 5,6 л = 5600 мл. По закону эквивалентов (1.5) Отсюда Пример 6. Из 3,85 г нитрата металла получено 1,6 г его гидроксида. Вычислите молярную массу эквивалентов металла. Решение. Молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей:
Молярная масса эквивалентов иона (катиона, аниона) равна отношению молярной массе иона к величине заряда иона:
где 1.3. Индивидуальные задания
1. а. Определите молярную массу эквивалентов магния, если известно, что при сгорании 4,56 г его образуется 7,56 г оксида магния. б. Рассчитайте молярную массу эквивалентов марганца в соединениях: 2. а. В хлориде меди (II) содержится 47,26 % меди. Зная, что молярная масса эквивалентов хлора равна 35,46 моль, определите молярную массу эквивалентов меди в этом соединении. б. Рассчитайте молярную массу эквивалентов элемента хлора в соединениях: 3. а. Определите молярную массу эквивалентов серной кислоты, если известно, что 98,08 г ее реагируют с 24,32 г магния, молярная масса эквивалентов которого – 12,16 моль. б. Рассчитайте молярные массы эквивалентов Мэ следующих веществ: 4. а. При разложении нагреванием 0,2318 г оксида металла получено 0,2158 г металла. Определите молярную массу эквивалентов металла. б. Рассчитайте молярную массу эквивалентов железа в соединениях: 5. а. На нейтрализацию 0,5358 г кислоты потребовалось 0,5 г щелочи, молярная масса эквивалентов которой равна 56,11 моль. Какова молярная масса эквивалентов кислоты? б. Рассчитайте молярные массы эквивалентов Мэ следующих веществ: 6. а. При сгорании 5 г металла образуется 9,44 г оксида металла. Определите молярную массу эквиваленов металла. б. Рассчитайте молярные массы эквивалентов Мэ следующих веществ: 7. а. Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,17 г одного из галогенов. Определите молярную массу эквивалентов галогена. б. Рассчитайте молярную массу эквивалентов металла в соединениях: 8. а. Масса 1 л (дм3) кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния, молярная масса эквивалентов которого равна 12 г/моль.
б. Рассчитайте молярную массу эквивалентов серы в соединениях: 9. а. Определите молярные массы эквивалентов металла и серы, если 3,24 г металла образует 3,48 г оксида и 3,72 г сульфида. б. Рассчитайте молярную массу эквивалентов фосфора в соединениях: 10. а. При соединении 5,6 г железа с серой образовалось 8,8 г сульфида железа. Найти молярную массу эквивалентов железа и его эквивалент, если известно, что молярная масса эквивалентов серы равна 16 г/моль. б. Рассчитайте молярные массы эквивалентов Мэ следующих веществ: 11. а. Вычислите атомную массу двухвалентного металла и определите, какой это металл, если 8,34 г металла окисляются 0,68 б. Рассчитайте молярные массы эквивалентов Мэ следующих веществ: 12. а. Мышьяк образует два оксида, из которых один содержит б. Рассчитайте молярные массы эквивалентов Мэ следующих веществ: 13. а. 1 г некоторого металла соединяется с 8,89 г брома и с 1,78 г серы. Найдите эквивалентные массы брома и металла, зная, что молярная масса эквивалентов серы равна 16 г/моль. б. Рассчитайте молярную массу эквивалентов металла в соединениях: 14. а. Определить массу гидросульфата натрия, образующегося при нейтрализации серной кислотой раствора, содержащего 8 г гидроксида натрия. б. Рассчитайте молярные массы эквивалентов Мэ следующих веществ:
15. а. Какое количество вещества эквивалента гидроксида кальция полностью прореагирует с серной кислотой массой 49 г? б. Рассчитайте молярную массу эквивалентов углерода в соединениях: 16. а. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определите молярную массу эквивалентов металла и объем выделившегося водорода (н.у.). б. Выразите в молях: 17. а. На восстановление 1,8 г оксида металла израсходовано б. Определите эквивалент и молярную массу эквивалентнтов азота, серы и хлора в соединениях 18. а. Некоторое количество металла, молярная масса эквивалентов которого равна 28 г/моль, вытесняет из кислоты 0,7 б. Вычислите эквиваленты и эквивалентные массы
19. а. Некоторое количество металла, молярная масса эквивалентов которого равна 27,9 г/моль, вытесняет из кислоты 700 б. Рассчитайте молярные массы эквивалентов Мэ следующих веществ: 20. а. 0,376 г алюминия при взаимодействии с кислотой вытеснили 0,468 б. Определите эквивалентные массы серы, фосфора и углерода в соединениях: 21. а. При взаимодействии 5,95 г некоторого вещества с 2,75 г хлороводорода получилось 4,4 г соль. Вычислите молярные массы эквивалентов вещества и образовавшейся соли. б. Вычислите эквиваленты и молярные массы эквивалентов 22. а. 1,6 г кальция и 2,61 г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить молярную массу эквивалентов цинка, зная, что молярная масса эквивалентов кальция равна 20 г/моль. б. Рассчитайте молярные массы эквивалентов Мэ следующих веществ: 23. а. В какой массе гидроксида натрия содержится тоже количество эквивалентов, что и в 140 г гидроксида калия? б. Напишите уравнения реакций гидроксид железа(III) с соляной кислотой, при которых образуется следующие соединения железа: хлорид дигидроксожелеза; дихлорид гидроксожелеза; трихлорид железа. 24. а. Из 1,35 г оксида металла получается 3,15 г его нитрата. б. Вычислите эквивалент и эквивалентную массу фосфорной кислоты в реакциях образования: гидрофосфата; дигидрофосфата; ортофосфата. 25. а. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалентов этого металла. б. Рассчитайте молярные массы эквивалентов (Мэ) следующих веществ: 26. а. Вычислите молярную массу эквивалентов металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 б. Рассчитайте молярную массу эквивалентов меди и серы в соединениях: 27. а. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалентов металла и его оксида. б. Рассчитайте молярные массы эквивалентов (Мэ) следующих веществ: 28. а. Из 3,31 г нитрата металла получается 2,78 г его хлорида. б. Рассчитайте молярную массу эквивалентов вольфрама в соединениях: 29. а. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалентов металла и его оксида. б. Вычислите молярную массу эквивалентов сернистой кислоты в реакциях образования: сульфита; гидросульфита. 30. а. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 б. Чему равен эквивалентный объем (н.у.) кислорода, водорода и хлора?
СТРОЕНИЕ АТОМА Теоретические сведения Химические свойства любого элемента определяются строением его атома. С исторической точки зрения теория строения атома последовательно разрабатывалась Э. Резерфордом, Н. Бором, Л. де Бройлем, Основные свойства и строение ядра (теория состава атомных ядер) 1. Ядра атомов всех элементов (за исключением водорода) состоят из протонов и нейтронов. 2. Число протонов в ядре определяет значение его положительного заряда Z.Z – порядковый номер химического элемента в периодической системе Д.И. Менделеева. 3. Суммарное число протонов и нейтронов – значение его массы, так как масса атома в основном сосредоточена в ядре (99,97 % массы атома). Ядерные частицы – протоны и нейтроны – объединяются под общим названием нуклоны (лат. nucleus, что означает «ядро»). Общее число нуклонов соответствует массовому числу, т.е. округленной до целого числа его атомной массе А: A = N + Z Ядра с одинаковыми Z, но различными А называются изотопами. Ядра, которые при одинаковом А имеют различные Z, называются изобарами. Всего известно около 300 устойчивых изотопов химических элементов и более 2000 естественных и искусственно полученных радиоактивных изотопов. 4. Число нейтронов в ядре N может быть найдено по разности между массовым числом А и порядковым номером Z: N = A – Z. 5. Размер ядра характеризуется радиусом ядра, имеющим условный смысл ввиду размытости границы ядра.
|
|||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 141; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.196.184 (0.072 с.) |
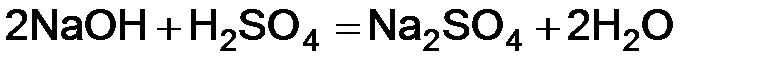 следует, что одному иону водорода соответствует одна молекула
следует, что одному иону водорода соответствует одна молекула  и одна
и одна  ,
, 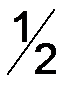 молекулы
молекулы  и
и 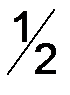 молекулы
молекулы 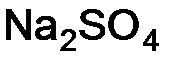 , поэтому
, поэтому  ) =
) =  , Э(
, Э( ) =
) = 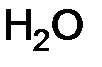 – это реальные частицы; Э(
– это реальные частицы; Э( ) =
) =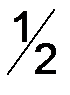
 ; Э(
; Э(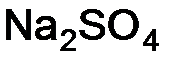 ) =
) = 
 – это условные частицы.
– это условные частицы. , г/моль.
, г/моль. ;
;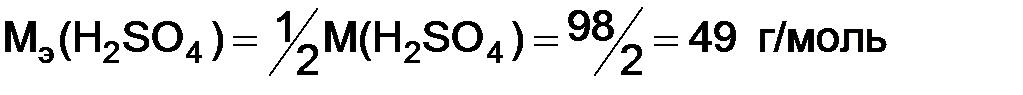 ;
; .
. ) = 1; fэ(
) = 1; fэ( ) =
) =  ;
; 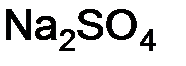 ) =
) = 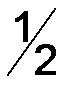 .
.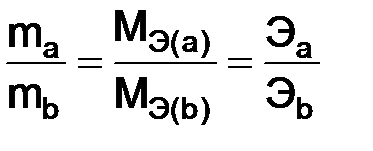 , (1.4)
, (1.4)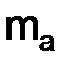 и
и 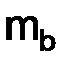 – массы веществ, г;
– массы веществ, г;  и
и  – молярные массы эквивалентов веществ, г/моль;
– молярные массы эквивалентов веществ, г/моль; 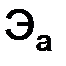 и
и 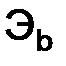 – эквиваленты веществ, моль.
– эквиваленты веществ, моль.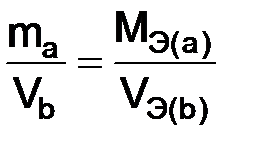 или
или  , (1.5)
, (1.5) – масса твердого или жидкого вещества, г;
– масса твердого или жидкого вещества, г; 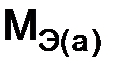 – молярная масса эквивалента твердого (жидкого) вещества, г/моль;
– молярная масса эквивалента твердого (жидкого) вещества, г/моль;  ,
,  – объем газообразного вещества н.у., л;
– объем газообразного вещества н.у., л; 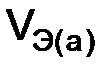 ,
, 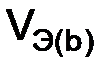 – молярный объем эквивалента газообразного вещества н.у., л/моль (дм3/моль).
– молярный объем эквивалента газообразного вещества н.у., л/моль (дм3/моль). – это объем, занимаемый одним эквивалентом газообразного вещества при нормальных условиях.
– это объем, занимаемый одним эквивалентом газообразного вещества при нормальных условиях. , (1.6)
, (1.6) – молярная масса элемента, г/моль;
– молярная масса элемента, г/моль;  – валентность элемента в данном соединении; fэ – фактор эквивалентности.
– валентность элемента в данном соединении; fэ – фактор эквивалентности.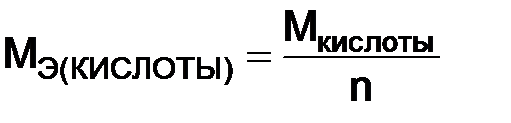 , (1.7)
, (1.7) – молярная масса кислоты;
– молярная масса кислоты; 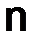 – число атомов водорода, вступивших в реакцию:
– число атомов водорода, вступивших в реакцию: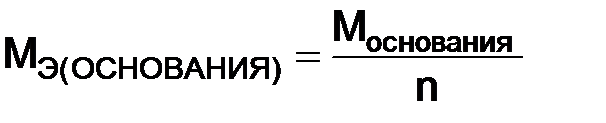 , (1.8)
, (1.8) – молярная масса основания;
– молярная масса основания; 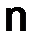 – число гидроксильных групп в основании, вступивших в реакцию:
– число гидроксильных групп в основании, вступивших в реакцию: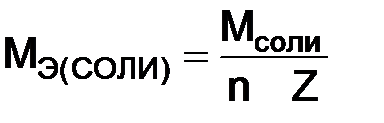 , (1.9)
, (1.9) – молярная масса соли;
– молярная масса соли; 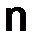 – число атомов металла, образующего соль;
– число атомов металла, образующего соль;  – валентность металла.
– валентность металла.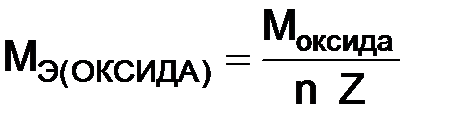 , (1.10)
, (1.10)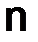 – число атомов элемента, образующего оксид;
– число атомов элемента, образующего оксид;  – валентность этого элемента.
– валентность этого элемента. .
. 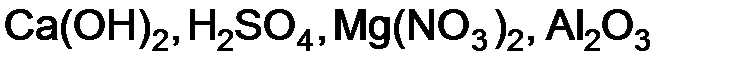 .
. = 40 + 2 · (16 + 2) = 76 г/моль.
= 40 + 2 · (16 + 2) = 76 г/моль.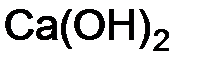 имеются две гидроксидные группы ОН, то в случае замещения в реакции одной из них n = 1:
имеются две гидроксидные группы ОН, то в случае замещения в реакции одной из них n = 1: = 76/1 = 76 г/моль,
= 76/1 = 76 г/моль,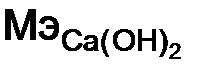 = 76/ 2 = 38 г/моль,
= 76/ 2 = 38 г/моль, – серная кислота. Расчет ведем по формуле (1.7):
– серная кислота. Расчет ведем по формуле (1.7): = 2 + 32 + 16 · 4 = 98 г/моль.
= 2 + 32 + 16 · 4 = 98 г/моль. = 98/1 = 98 г/моль, а двух n= 2,
= 98/1 = 98 г/моль, а двух n= 2,  = 98/2 = 49 г/моль;
= 98/2 = 49 г/моль; 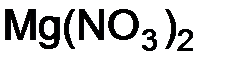 – нитрат магния, соль. Расчет ведем по формуле (1.9):
– нитрат магния, соль. Расчет ведем по формуле (1.9): 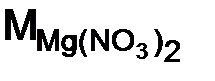 = 24 + 2 · (14 + 16 · 3) = 148 г/моль; n= 1 (количество атомовнов металла); Z= 2 (валентность металла)
= 24 + 2 · (14 + 16 · 3) = 148 г/моль; n= 1 (количество атомовнов металла); Z= 2 (валентность металла)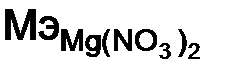 = 148/ 2 = 74 г/моль;
= 148/ 2 = 74 г/моль; – оксид алюминия. Расчет ведем по формуле (1.10):
– оксид алюминия. Расчет ведем по формуле (1.10):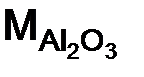 = 27 · 2 + 16 · 3 = 102 г/моль; n= 2 (количество металла); Z= 3 (валентность металла)
= 27 · 2 + 16 · 3 = 102 г/моль; n= 2 (количество металла); Z= 3 (валентность металла) = 102 / 6 = 17 г/моль.
= 102 / 6 = 17 г/моль. ,
,  г/моль, можно найти молярную массу эквивалентов металла:
г/моль, можно найти молярную массу эквивалентов металла: 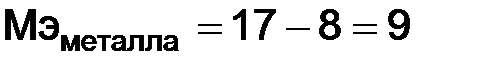 г/моль, по закону эквивалентов (1.5) найдем количество металла, вступившего в реакцию: mметалла = 9,43 × 9 / 17 = 4,99 г.
г/моль, по закону эквивалентов (1.5) найдем количество металла, вступившего в реакцию: mметалла = 9,43 × 9 / 17 = 4,99 г. л водорода, н.у. Вычислите молярную массу эквивалентов оксида и молярную массу эквивалентов металла.
л водорода, н.у. Вычислите молярную массу эквивалентов оксида и молярную массу эквивалентов металла.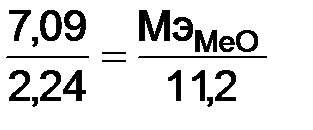 ;
; = 7,09 · 11,2 / 2,24 = 35,45 г/моль.
= 7,09 · 11,2 / 2,24 = 35,45 г/моль. =
=  –
–  = 35,45 – 8 =
= 35,45 – 8 = 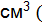 мл) кислорода, н.у.?
мл) кислорода, н.у.?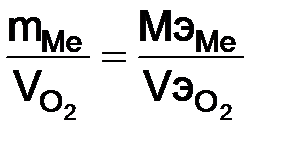 ;
; 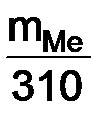 =
= 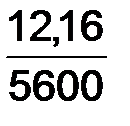 .
.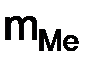 = 310 · 12,16: 5600 = 0,673 г.
= 310 · 12,16: 5600 = 0,673 г. .
.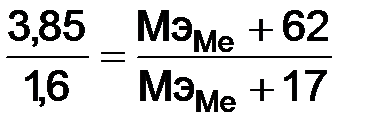 ,
, = 15 г/моль.
= 15 г/моль.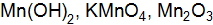 .
. .
.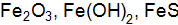 .
. .
. .
.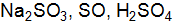 .
. .
. .
. .
.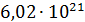 молекул
молекул 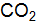 ;
; 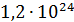 атомов азота;
атомов азота; 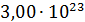 молекул воды. Чему равна молярная масса указанных веществ?
молекул воды. Чему равна молярная масса указанных веществ?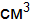 водорода (н.у.). Вычислите молярную массу эквивалентов оксида и металла.
водорода (н.у.). Вычислите молярную массу эквивалентов оксида и металла.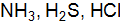 .
.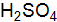 в реакциях, выраженных уравнениями:
в реакциях, выраженных уравнениями: 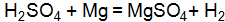 :
: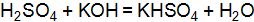 .
.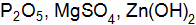 .
.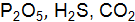 .
.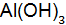 в реакциях, выраженных уравнениями:
в реакциях, выраженных уравнениями: 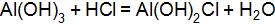 ,
, 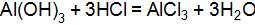 .
.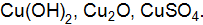
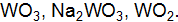
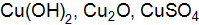 .
.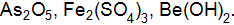
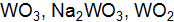 .
.


