Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Условный (промежуточный) метод⇐ ПредыдущаяСтр 25 из 25
Условимся, что более электроотрицательный атом, смещая к себе одну электронную пару, приобретает заряд –1, две электронных пары — заряд –2. Связь между одинаковыми атомами не дает вклада в степень окисления, следовательно, для атомов С–С степень окисления равна 0. В ковалентной связи C–H углероду соответствует заряд –1 (более электроотрицательный), а в связи C–O заряд углерода равен +1 (менее электроотрицательный). Степень окисления атома в молекуле подсчитывается как алгебраическая сумма зарядов, которые дают все связи данного атома. Например, в молекуле хлорметана CH3Cl, три связи C–H дают суммарный заряд на атоме C, равный –3, а связь C–Cl — заряд +1. Следовательно, степень окисления атома углерода в этом соединении равна: –3 + 1 = –2.
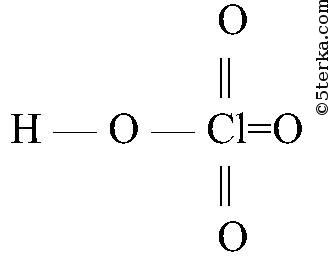
Самостоятельная работа "Химический пазл" Формулы химических соединений могут быть изображены по-разному. Определение Структурная формула — форма записи, отображающая химическое строение (структуру) молекулы, составленная из символов химических элементов и специальных знаков (черточек), обозначающих взаимосвязь элементов в соответствии с их валентностью. Например,
Рисунок 1. Структурная формула хлорной кислоты (HClO4) Для построения структурных формул необходимо знать валентность каждого элемента в рассматриваемом соединении. Определение Пространственная формула — структурная формула, отражающая расположение элементов в пространстве относительно друг друга.
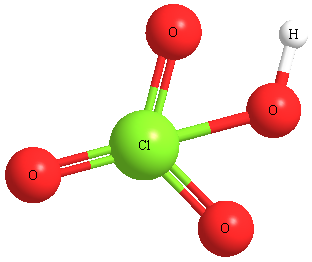
Наиболее наглядной формой изображения молекулы является ее шаростержневая модель (рисунок 2), однако на подобных рисунках иногда не отображают кратность связи (сравните с рисунком 1).
Рисунок 2. Пространственные формулы хлорной кислоты (HClO4) Модель дает представление не только о расположении элементов в пространстве относительно друг друга, но и соотношениях длин связи и валентных углах. На таких изображениях общепринято использовать одни и те же цвета для обозначения атомов элементов: атомов элементов:
Таблица 1. Общепринятые цвета условного обозначения атомов различных элементов
Попробуйте изготовить структурные формы молекул своими руками, это будет напоминать пазл. ЧТО ПОНАДОБИТСЯ:
КАК СДЕЛАТЬ:
Таблица 2. Распространенные степени окисления некоторых элементов
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 303; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.114.38 (0.005 с.) |