Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
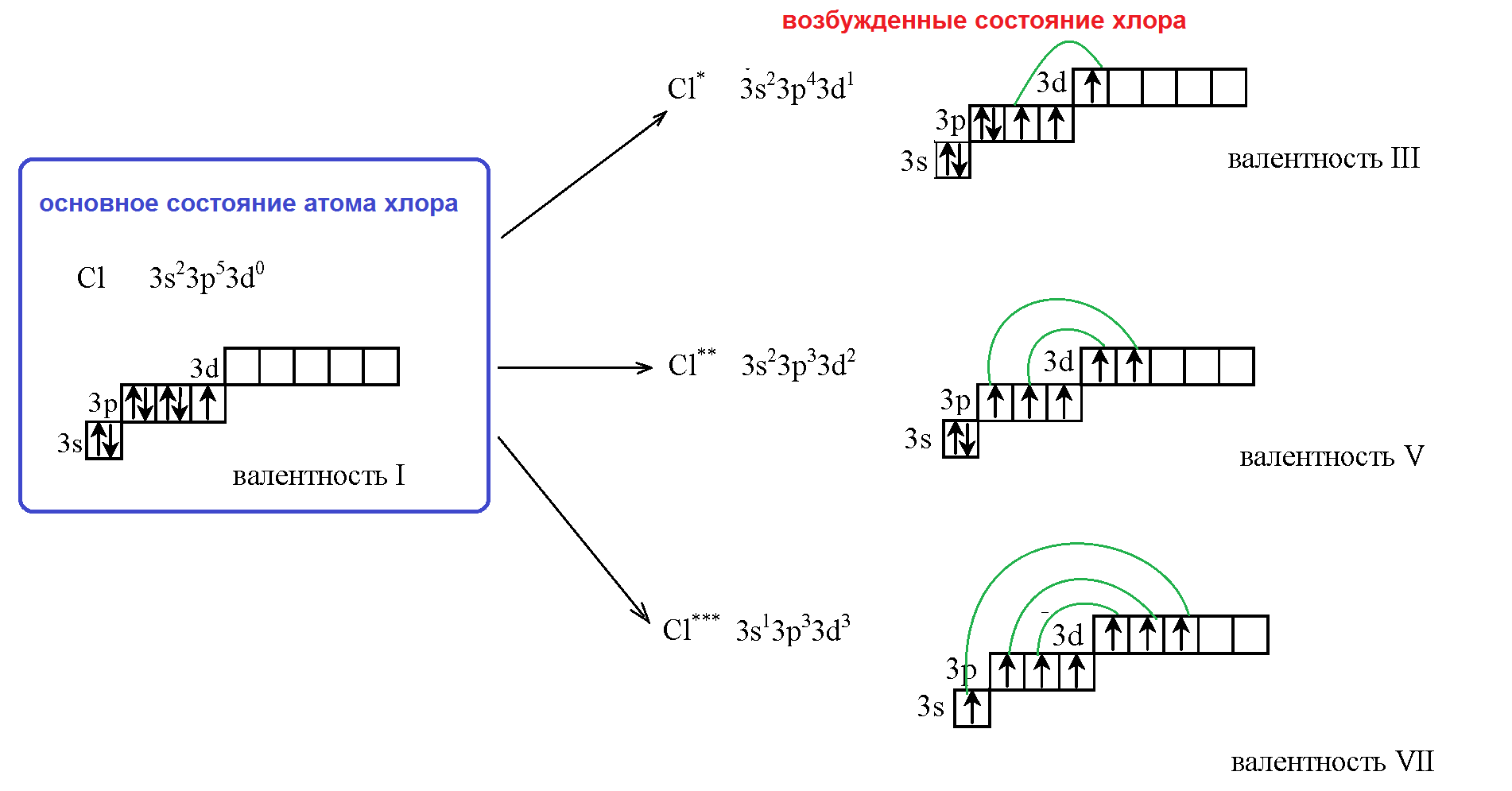
Возбужденное состояние атома
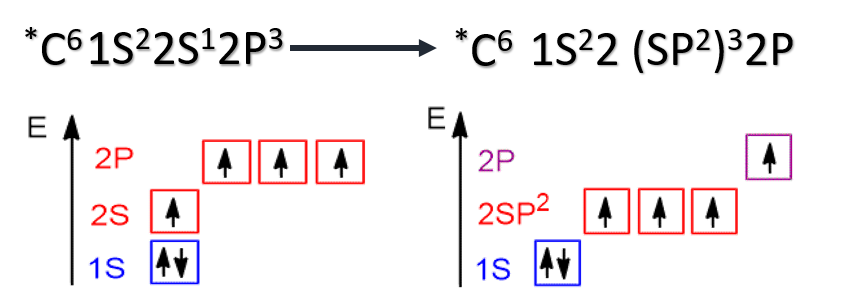
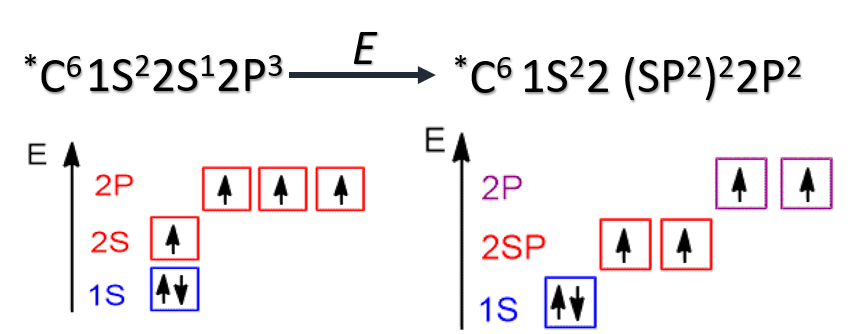
Все электронные конфигурации, о которых мы говорили выше, являются конфигурациями с наименьшей энергией и соответствуют основному состоянию атома. Получив энергию извне (облучение или нагревание системы), один либо несколько электронов могут переходить на более высокий энергетический подуровень. Определение Состояние атома, при котором электрон из электронной пары с предыдущего подуровня «распаривается» и переходит на следующий подуровень, называется возбужденным состоянием атома. Возбужденное состояние атома является неустойчивым, и через некоторое время электрон теряет энергию, перейдя на энергетическую орбиталь с меньшей энергией, испустив при этом квант света. Определение Состояние, которое требует для повышения энергии электрона наименьших энергетических затрат, называют первым возбужденным состоянием. Состояние, при котором все валентные электроны являются неспаренными, называют максимально возбужденным состоянием. Например, для атома хлора возможны три возбужденных состояния, обозначенные на рисунке как Cl*, Cl**, Cl***, причем последнее является максимально возбужденным состоянием. У атомов в возбужденном состоянии меняется число валентных электронов и, соответственно, возможная степень окисления.
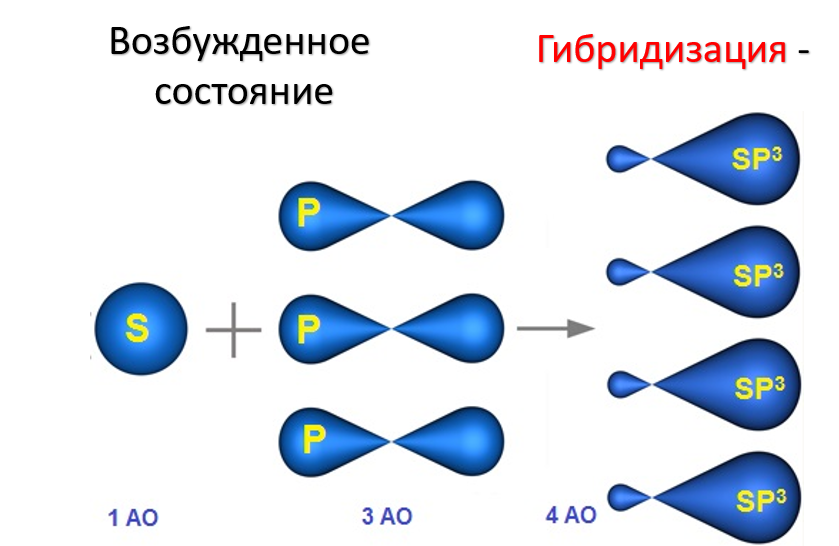
Гибридизация атома углерода Сложность статьи улучшить школьные оценкиузнать больше, чем в школепобедить в олимпиаде Определение Гибридизация АО - смешение атомных орбиталей (электронных облаков) различного типа (например, s и p), в результате которого образуются одинаковые по форме и энергии гибридные орбитали. Число образующихся гибридных орбиталей равно числу орбиталей, которые участвуют в гибридизации. Химические связи возникают при перекрывании гибридных АО с АО других атомов. Основные типы гибридизации, характерные для атома углерода: sp3, sp2, sp. sp3 - гибридизация sp3-Гибридизация характерна для предельных органических соединений. В этом случае атомы углерода образуют четыре одинарные связи, т.е. валентность атомов углерода равна IV. Такую валентность атом углерода имеет в возбужденном состоянии: 2s12p3. В результате гибридизации одной 2s-орбитали и трех 2p-орбиталей образуются четыре sp3-гибридные орбитали, одинаковые по форме и энергии:
Образование sp3-гибридизованных АО в атоме углерода, можно показать также с помощью графической картинки:
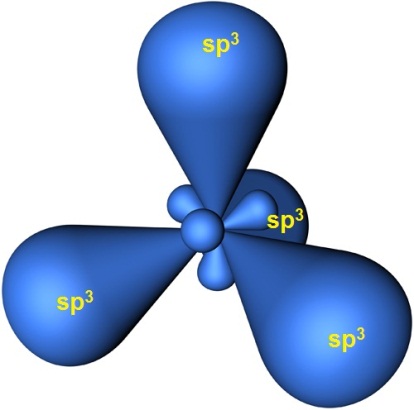
Четыре гибридные орбитали располагаются под углом 109^o5^'109^o5^' друг к другу и направлены к вершинам тетраэдра, в центре которого находится ядро атома углерода:
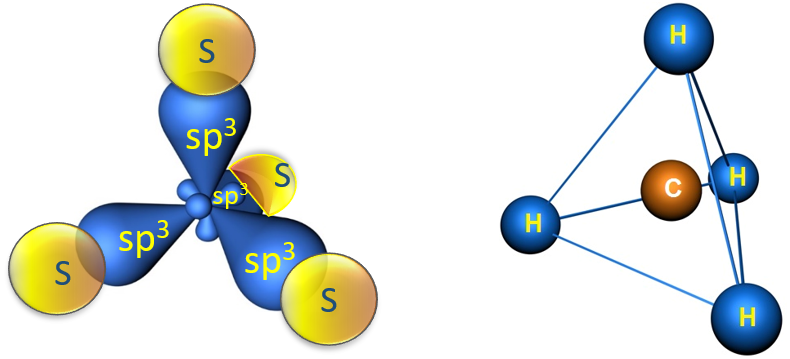
Образовавшиеся гибридные АО могут перекрываться другими АО, например 1s-орбиталями атомов водорода. Химические связи в молекуле метана образуются вдоль линии, соединяющей ядра атомов. Геометрическая форма молекулы CH4 - тетраэдр:
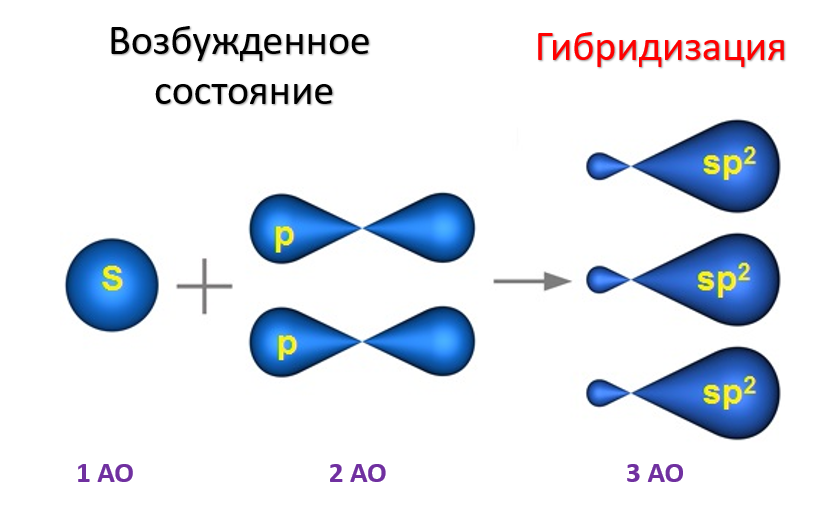
sp2 - ГИБРИДИЗАЦИЯ sp2-гибридизация характерна для органических соединений, содержащих двойную связь. В этом случае одна 2s-орбиталь и две 2p-орбитали образуют три sp2-гибридные орбитали, одинаковые по форме и энергии, а негибридизованная 2р-АО выше по энергии и имеет форму гантели:
Образование sp2-гибридизованных АО в атоме углерода можно показать также с помощью графической картинки:
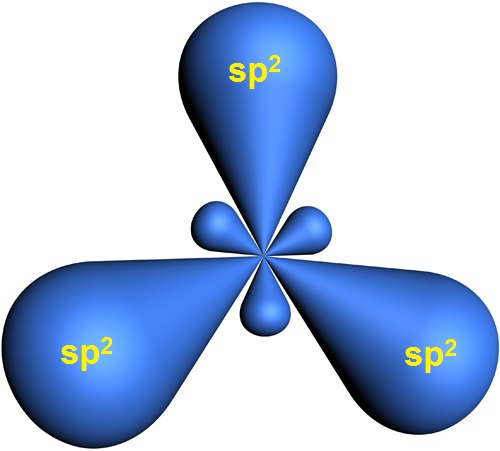
Три гибридные орбитали располагаются под углом 120o друг к другу и направлены к вершинам правильного треугольника, в центре которого находится ядро атома углерода:
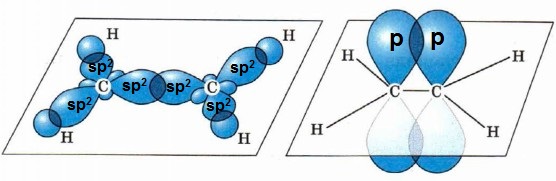
Три sp2-гибридные орбитали атома углерода образуют три σ-связи с 1s-орбиталями атомов водорода или орбиталями других атомов, например углерода. Негибридная р-АО также участвует в образовании связи в результате бокового перекрывания с другой негибридной p-АО орбиталью другого атома углерода:
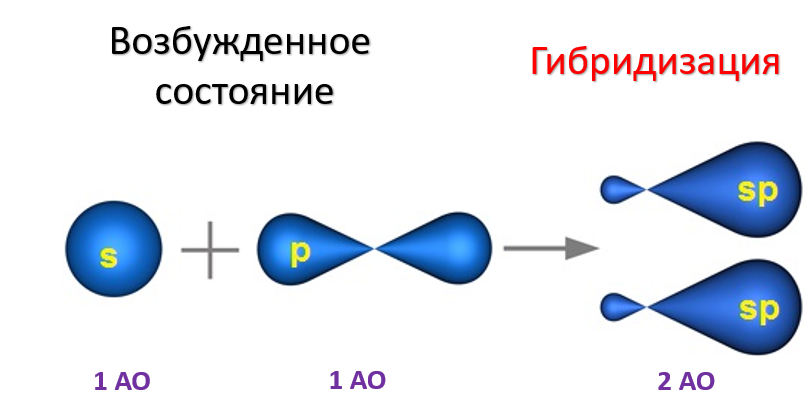
sp - ГИБРИДИЗАЦИЯ sp-Гибридизация характерна для органических соединений, содержащих тройную связь. В этом случае одна 2s-орбиталь и одна 2p-орбиталь образуют две sp-гибридные орбитали, одинаковые по форме и энергии, а негибридизованные две 2р-АО выше по энергии и имеют форму гантели:
Образование sp-гибридизованных АО в атоме углерода можно показать также с помощью графической картинки:
Две гибридные орбитали располагаются под углом 180o друг к другу:
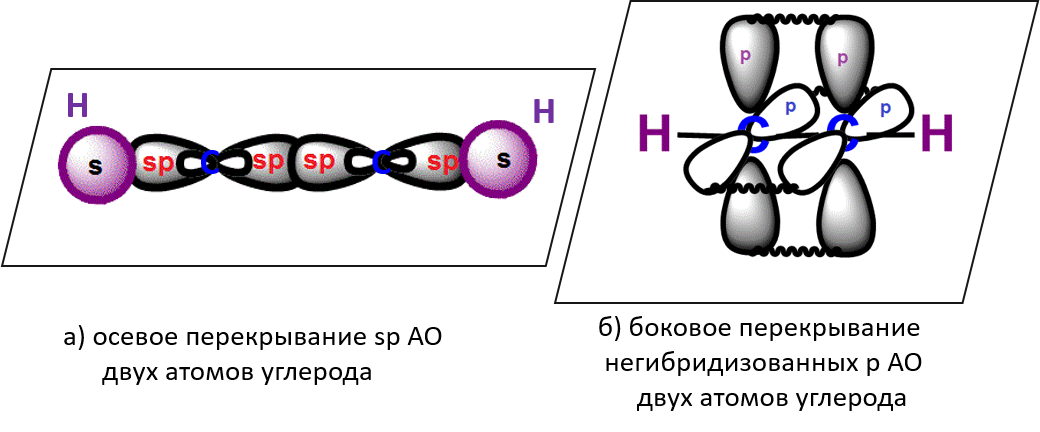
Две гибридные sp-АО участвуют в образовании σ-связей, а две негибридные 2р-АО образуют две π-связи с соседними негибридными p-АО в результате бокового перекрывания:
|
|||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 605; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.22.136 (0.009 с.) |