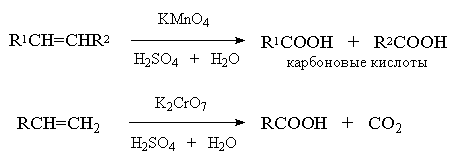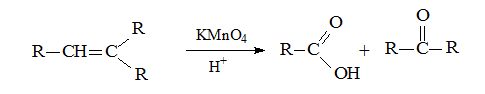Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окисление и восстановление органических веществ в присутствии неорганических соединений
В окислительно-восстановительных реакциях органические вещества чаще всего проявляют свойства восстановителей, при этом сами окисляются. Легкость окисления зависит от доступности электронов при взаимодействии с окислителем. Все факторы, приводящие к увеличению электронной плотности (например, положительный индуктивный эффект. мезомерный эффект) повышают способность вещества к окислению. Таким образом, склонность органических веществ к окислению возрастает с повышением их нуклеофильности, что соответствует следующим рядам. Для функциональных групп: R−H<R−OH<R−NH2 Для атомов углерода (по степени замещенности: −CH3 первичный углерод < −CH2− вторичный углерод < −CH= третичный углерод. Для кратных связей: С-С < С≡С < C=C Реакции Окисления Окисление углеводородов Окисление углеводородов с кратной связью обычно проводится в присутствии окислителя – перманганата калия KMnO4 в различных средах (кислой, щелочной или нейтральной). В зависимости от реакции среды и условий проведения реакции можно получать различные продукты окисления углеводородов и восстановления соединений марганца– в кислой среде MnSO4, в нейтральной и щелочной – MnO2. KMnO4 и другие неорганические окислители, такие как HNO3,K2Cr2O7,CuO; и др. относятся к условным окислителям и в органических уравнениях обозначаются как [O]. Запомни! Алканы, в отличии от непредельных и ароматических УВ, химическому окислению не подвергаются. Рассмотрим особенности и условия окисления алкенов, алкинов и аренов. Окисление алкенов
При окислении монозамещенных алкенов образуется карбоновая кислота и углекислый газ. Дизамещенные алкены, содержащие разные алкильные группы у двух атомов углерода двойной связи при окислении дают смесь карбоновых кислот:
Окисление тризамещенных алкенов приводит к смеси карбоновой кислоты и кетона:
Тетразамещенные симметричные алкены при окислительном расщеплении образуют две молекулы кетона, а несимметричные – смесь двух разных кетонов:
Окисление алкинов
Окисление аренов (гомологов бензола)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||