Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Алгоритм вычисления валентности элемента в соединении
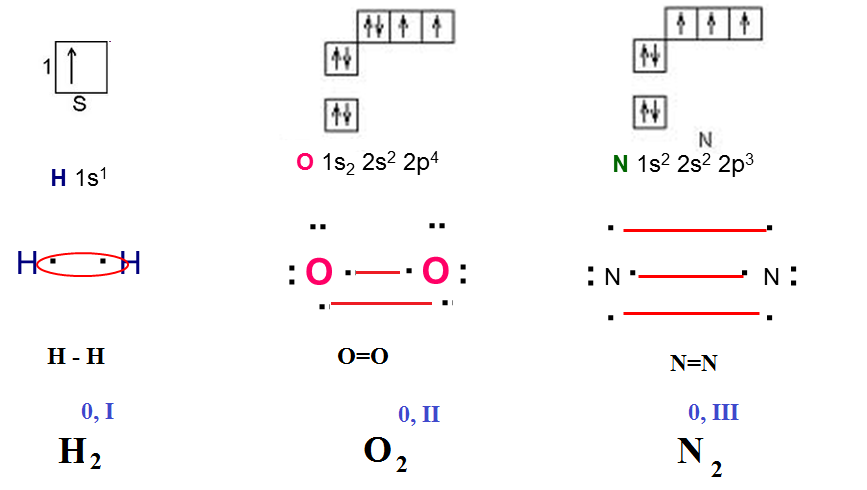
Зачастую численные значения степени окисления и валентности совпадают. Однако в некоторых соединениях, например в простых веществах, их значения могут различаться.
Так, молекула азота образована двумя атомами азота, связанными тройной связью. Связь образована тремя общими электронными парами за счет присутствия трех неспаренных электронов на 2p-подуровне атома азота. То есть валентность азота равна трем. В то же время N2 — простое вещество, а значит, степень окисления этой молекулы равна нулю. Аналогично, в молекуле кислорода валентность равна двум, а степень окисления — 0; в молекуле водорода валентность — I, степень окисления — 0. Так же как в простых веществах, степень окисления и валентность часто отличаются в органических соединениях. Подробнее это будет рассмотрено в теме «ОВР в органической химии». Для определения валентности в сложных соединениях сначала нужно построить структурную формулу. В структурной формуле одна химическая связь изображается одной «черточкой». При построении графических формул нужно учитывать ряд факторов:
Тема: ОВР в органической химии Типы окислительно-восстановительных реакций в органической химии Реакции горения Определение Горение - это физико-химический процесс взаимодействия веществ с окислителями, чаще всего с кислородом, в результате которого происходит превращение исходных веществ в продукты сгорания, и сопровождающийся интенсивным выделением теплового излучения и света. Светящаяся зона называется пламенем. Горение органических веществ - окислительно-восстановительная реакция. Все органические вещества сгорают на воздухе с образованием углекислого газа CO2 и паров воды H2O. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
В условиях недостатка кислорода при горении может также образовываться угарный газ CO или элементарный углерод (сажа). Обычно, если органическое вещество содержит в своей структуре атомы азота, например амины, гетероциклические соединения и др., то в продуктах горения содержится молекулярный азот N2; если содержится хлор (хлорпроизводные), то в продуктах присутствует хлороводород HCl, если сера (тиолы, гетероциклы) – диоксид серы SO2. Чем больше в молекуле атомов углерода, тем более коптящим будет пламя из-за неполного сгорания и образования твердых частиц углерода (сажи), и тем больше кислорода требуется на ее сгорание. Например, метан горит голубым, этиловый спирт - почти бесцветным, а бензол – желтым коптящим пламенем.
Уравнение реакции горения алканов в общем виде можно записать следующим образом: CnH2n+2+3n+12O2→nCO2+(n+1)H2O+Q Рассмотрим несколько примеров. Задача 1 Написать уравнение реакции горения метана, рассчитать коэффициенты методом электронного баланса. Решение 1.Напишем схему реакции горения метана. Как мы знаем, все углеводороды, не содержащие азота или других гетероатомов, сгорают с образованием углекислого газа и воды: CH4+O2⟶CO2+H2O 2. Определим степени окисления (CО) элементов в соединениях алгебраическим методом: В молекуле метана CH4 неизвестна СО углерода: CxH4+1, находим суммарный заряд на атомах водорода: 4∙(+1)=+4, следовательно, с противоположным знаком x=-4 В молекуле кислорода O2: простое вещество, следовательно СО равна нулю O20 В молекуле углекислого газа CO2 также находим СО углерода в молекуле: CxO2−2 как суммарный заряд на кислороде: 2 ∙(-2) =-4 с противоположным знаком x=+4 В молекуле воды степени окисления элементов постоянные: H2+O−2 3. Проставим найденные степени окисления в молекулах в уравнении реакции: реакции: C−4H4+1+O20⟶C+4O2−2+H2O 4. Определим, какие элементы поменяли степень окисления во время реакции: C−4⟶C+4 O20⟶2O−2 5. Составим электронный баланс:
C−4−8e¯⟶C+4 | 4 | 1 O20+4e¯⟶2O−2 | 8 | 2 Коэффициенты в балансе кратны 4-ем, поэтому сокращаем их, разделив на 4. В данной реакции углерод является восстановителем (отдает электроны), а кислород – традиционно окислителем (принимает электроны) 6. Выставляем полученные коэффициенты в уравнение реакции перед элементами, к которым они относятся: C−4H4+1+2O20⟶C+4O2−2+2H2+O−2 Таким образом, на полное сгорание 1 моль метана требуется 2 моль кислорода.
Задача 2 Определить, на сгорание какого газа требуется больше кислорода: бутана или этана. Решение 1. Напишем химические схемы горения этана и бутана. Алгоритм составления уравнений аналогичен предыдущей задаче: C2−3H6+1+O20⟶C+4O2−2+H2+O−2 C4−xH10+1+O20⟶C+4O2−2+H2+O−2 2. Особо следует остановиться на определении степени окисления углерода в молекуле бутана. В молекуле бутана (CH3−CH2−CH2−CH3) каждый атом водорода имеет степень окисления «+1», крайние атомы углерода имеют степени окисления «-3», центральные атомы угле рода имеют степени окисления «-2» (см. условный метод нахождения СО). Суммарный заряд на атомах углерода равен алгебраической сумме: (-3)∙2 +(-2)∙2= -10. 3. Составляем балансы для обоих уравнений: C−3−7e¯→C+4 | 4 O20+4e¯→2O−2 | 7 (C4)−10−26e¯→4C+4 | 4 | 2 O20+4e¯→2O−2 | 26 | 13 В данных реакциях углерод – восстановитель, а кислород - окислитель. 4. Заносим коэффициенты в уравнения реакций: 2C2−3H6+1+7O20⟶4C+4O2−2+6H2+O−2 2C410H10+1+13O20⟶8C+4O2−2+10H2+O−2 Таким образом, получаем, что на полное сгорание 2 моль этана требуется 7 моль кислорода (или 1:3,5), а на сгорание 2 моль бутана - 13 моль кислорода (или 1:7,5).
|
||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 227; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.187.24 (0.007 с.) |