Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Степень окисления, валентность и электроотрицательность
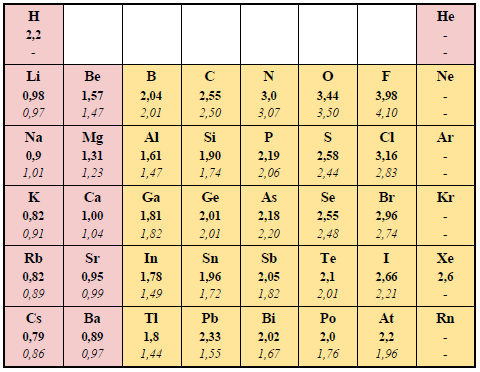
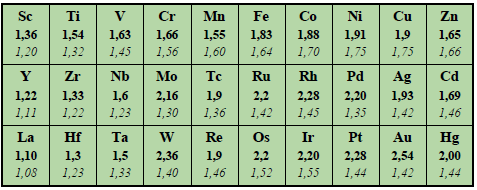
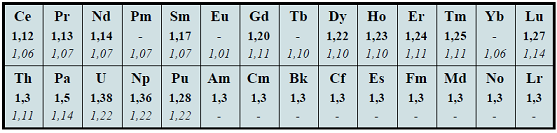
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ Определение Электроотрицательность (ЭО) χ (хи) - величина, характеризующая способность атома элемента притягивать к себе электроны при образовании химической связи с другими атомами.
Современное понятие об электроотрицательности атомов введено американским учёным Лайнусом Полингом в 1932 году. Теоретическое определение электроотрицательности было разработано позднее. Американский физик Роберт Малликен предложил рассчитывать электроотрицательность как полусумму потенциала ионизации и сродства к электрону: МχМ=I+Ae2, где I - потенциал ионизации, Ae - энергия сродства к электрону. Помимо шкалы Малликена, описанной выше, существует более 20-ти различных других шкал электроотрицательности (в основу расчёта значений которых положены разные свойства веществ), среди которых шкала Л. Полинга (основана на энергии связи при образовании сложного вещества из простых), шкала Олреда-Рохова (основана на электростатической силе, действующей на внешний электрон) и др. В настоящее время существует много способов, позволяющих количественно оценить величину электроотрицательности атома. Значения электроотрицательностей элементов, рассчитанные разными способами, как правило, не совпадают даже при введении поправочных коэффициентов. Однако общие тенденции в изменении χ по Периодической системе сохраняются. Проиллюстрировать это можно, сравнив две наиболее широко использующиеся шкалы - по Полингу и по Олреду-Рохову (жирным шрифтом выделены значения ЭО по шкале Полинга, курсивом - по шкале Олреда-Рохова; s-элементы выделены розовым цветом, p-элементы - жёлтым, d-элементы - зелёным, f-элементы - голубым):
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, типа соединения, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. Электроотрицательность связана с окислительно-восстановительной активностью элемента. Соответственно, чем больше электроотрицательность элемента, тем сильнее его окислительные свойства.
Чем более приближена электронная оболочка данного атома к электронной оболочке инертного газа, тем выше его электроотрицательность. Иными словами, в периодах по мере заполнения внешнего энергетического уровня электронами (то есть слева направо) электроотрицательность возрастает, так как возрастает номер группы и количество электронов на внешнем энергетическом уровне. Чем дальше оказываются валентные электроны от ядра, тем слабее они удерживаются и тем ниже способность атома притягивать к себе дополнительные электроны. Таким образом, в группах электроотрицательность возрастает с уменьшением атомного радиуса, то есть снизу вверх. Элементом с наибольшей электроотрицательностью является фтор, а с наименьшей - франций. Типичные неметаллы, таким образом, имеют высокие значения электроотрицательности, а типичные металлы - низкие.
|
|||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 227; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.31.209 (0.005 с.) |