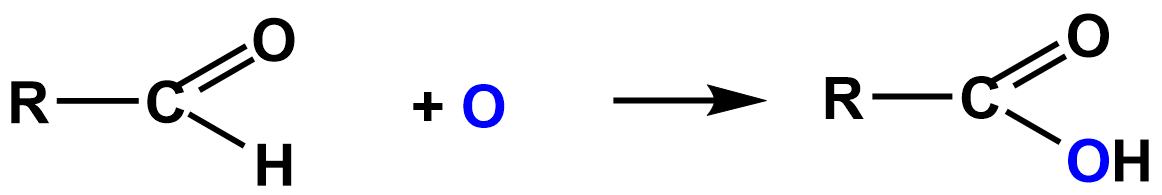Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окисление альдегидов и кетонов
Благодаря тому, что в альдегидах имеется атом водорода, связанный с карбонильной группой, они чрезвычайно легко окисляются не только разными окислителями, но даже и кислородом воздуха. Особенно легко окисляются ароматические альдегиды. Запомни! В молекулах образующихся кислот столько же атомов углерода, сколько их было в исходном альдегиде. В общем виде уравнение окисления альдегидов можно записать следующим образом:
Для качественного определения альдегидов чаще всего пользуются реакцией «серебряного зеркала», то есть реакцией восстановления аммиачного раствора окиси серебра (реактив Толленса), при этом серебро выделяется на стенках пробирки в виде зеркального слоя. R–CH=O+2[Ag(NH3)2]OH⟶RCOOH+2Ag↓+4NH3↑+H2O Для этой же цели пользуются реакцией восстановления «фелинговой жидкости» (реактив Фелинга: раствор CuSO4 и 10% раствор NaOH в присутствии тартратов или свежеприготовленный гидроксид меди). При этом, в присутствии восстановителей - альдегидов голубой аморфный осадок гидроксида меди превращается при нагревании в красный осадок закиси меди: R–CH=O+2Cu(OH)2↓⟶RCOOH+Cu2O↓+2H2O Запомни! Кетоны не вступают в реакцию "серебряного зеркала" и окисляются значительно труднее альдегидов — только при действии сильных окислителей (например, KMnO4 или азотная кислота) и повышенной температуре. При этом обыкновенно разрывается связь между карбонильной группой и одним из алкилов и получаются кислоты с меньшим числом атомов углерода в молекуле. Так как связь между углеродными атомами может разорваться с каждой стороны карбонильной групп, а число атомов углерода в радикалах может быть различным (правило окисления кетонов А. Н. Попова), то в наиболее общем случае получается смесь четырех кислот: R′−CH2−C(O)−CH2−R”+[O]⟶R′−COOH+R−CH2−COOH+R”−COOH+R”−CH2−COOH Механизм окисления выглядит следующим образом:
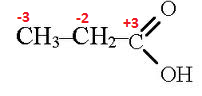
Задача 3 Написать уравнение реакции окисления диэтилкетона перманганатом калия и вычислить коэффициенты методом электронного баланса Решение Напишем полное уравнение реакции окисления, помня, что в соответствии с правилом Попова, должно получиться четыре кислоты, в данном случае - по две молекулы уксусной и пропионовой кислот:
CH3−CH2−C(O)−CH2−CH3+KMnO4+H2SO4⟶CH3COOH+CH3−CH2−COOH+MnSO4+K2SO4+H2O Определим степени окисления углерода в молекулах диэтилкетона и в молекулах кислот:
Запишем электронный баланс. В молекуле диэтилкетона атомы углерода окисляются до –COOH. Марганец в кислой среде восстанавливается до Mn+2: C+2−1e¯→C+3 ССС−2−5e¯→С+3 Mn+7+5e¯→Mn+2|6 Проставляем полученные коэффициенты в уравнение реакции, уравниваем кислород и водород: 5CH3−CH2−C(O)−CH2−CH3+6KMnO4+9H2SO4⟶5CH3COOH+5CH3−CH2−COOH+6MnSO4+3K2SO4+9H2O Реакции восстановления Чаще всего для восстановления используют процессы гидрирования, то есть взаимодействие с водородом в присутствии металлических катализаторов. Для гидрирования кратной связи С=С или С≡С в качестве катализаторов могут быть использованы платиновая чернь, скелетный никелевый катализатор (никель Ренея), никель на носителях, медь, смешанные оксидные катализаторы и др. В промышленной практике обычно применяют металлический никель и никель, осажденный на оксиде алюминия, оксиде хрома или других носителях. Обычно реакция идет уже при комнатной температуре и атмосферном давлении. Гидрирование ароматических углеводородов идет в присутствии тех же катализаторов, но при нагревании. Задача 1 Написать уравнение реакции гидрирования пропена, рассчитать коэффициенты методом электронного баланса. Решение Уравнения окислительно-восстановительных реакций в этом случае составляются достаточно просто: CH3−CH=CH2+H2⟶CH3−CH2−CH3 Определим степени окисления углерода в молекулах пропена и пропана:
Составим электронный баланc. При гидрировании атомы углерода, образующие двойную связь, меняют свои степени окисления: C−1+1e¯→C−2 C−2+1e¯→C−3 H20−2e¯→2H+|2|1 Таким образом, на один моль пропена расходуется 1 моль водорода. Альдегиды и кетоны сравнительно легко гидрируются в присутствии катализаторов гидрирования. Эту реакцию часто используют в промышленном синтезе первичных и вторичных спиртов. В реакциях восстановления водород взаимодействует с кислородсодержащими группами - карбонильной, карбоксильной, нитрогруппой и др. Различают реакции восстановления без выделения воды и реакции восстановления с выделением воды. Процессы восстановления часто проводят на тех же катализаторах, которые применяются для гидрирования кратных связей.
Механизм нитрования Сложность статьи узнать больше, чем в школепобедить в олимпиаде Определение Нитросоединения — органические соединения, содержащие одну или несколько нитрогрупп —NO2. Под нитросоединениями обычно подразумевают углеводороды, в которых нитрогруппа непосредственно связана с атомом углерода (нитроалканы, нитроалкены и нитроарены и т.д.). Наиболее важный метод получения нитросоединений - нитрование. Определение Нитрование – непосредственное замещение атома водорода в органическом соединении NO2 -группой. Различают С-, О- и N-нитрование, направленные на синтез С-нитропроизводных, органических нитратов (нитроэфиров) R−ONO2 и N-нитраминов RNHNO2. Обычно субстратом служат карбоциклические и гетероциклические ароматические соединения. Алифатические соединения нитруются значительно реже. Нитрующими агентами являются азотная кислота и её смеси с разными реагентами, чаще всего, с сильными неорганическими кислотами. Основным побочным процессом при нитровании является окисление. Нитрование менее селективно, чем сульфирование, вследствие меньшего размера и большей активности атакующей частицы. Тем не менее, правильный выбор нитрующего агента позволяет существенно повысить выход целевого продукта Другие способы получения нитросоединений (например, нуклеофильной заменой галогена) имеют значительно меньшее значение.
|
||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 286; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.128.22 (0.013 с.) |