
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кількісне визначення фотометричним методом
Кількісне в изначення сумарного вмісту аміаку й іонів Методика визначення 1. Побудова градуювального графіка Виходячи з попередньої якісної оцінки вмісту азоту аміаку(іонів амонію) у воді, готують серію стандартних розчинів для побудови градуювального графіка. Для цього в ряд мірних колб місткістю 50 мл послідовно вносять 0–0,5–1–1,5–2–3 мл робочого стандартного розчину (1 мл розчину містить 0,05 мг іонів Градуювальний графік будують у координатах оптична густина – концентрація іонів NH4 + (мг/л).
2. Визначення вмісту аміаку і NH4 + - іонів у пробі води У колбу на 50 мл наливають досліджувану воду, додають по 1 мл сегнетової солі й реактиву Несслера, витримують 10 хв. і фотоколориметрують щодо нульової проби. Сумарний вміст аміаку й іонів 13.4. Визначення вмісту Нітрити – нестійкі сполуки, тому їх слід визначати одразу після відбору проб води. Якщо це неможливо, то пробу води необхідно консервувати додаванням 1 мл сульфатної кислоти або 2–4 мл хлороформу на 1 л відібраної проби. Принцип методу. Метод ґрунтується на здатності іонів Спочатку азотиста кислота
а потім сіль діазонію вступає в реакцію з
Інтенсивність забарвлення, пропорційна вмісту нітритів, виміряють на фотоелектроколориметрі з зеленим світлофільтром при довжині хвилі 520 нм.
Реактиви, посуд, прилади 1. Пробірки діаметром 13–14 мм. 2. Колби місткістю 50 мл. 3. Піпетки місткістю 1, 2, 5, 50 мл. 4. Реактив Грисса, сухий реактив або 10% розчин у 12 % розчині оцтової кислоти. Якщо немає готового препарату, то його готують у такий спосіб: а) 0,5г сульфанілової кислоти розчиняють у 150 мл 12% розчині оцтової кислоти; б) 0,1г a-нафтиламіну розчиняють при нагріванні в 20 мл дистильованої води, фільтрують і змішують з 150 мл 12% розчину оцтової кислоти. Розчини зберігають окремо на холоді протягом 2-х місяців. Перед застосуванням одну частину розчину «а» змішують з рівною за об'ємом частиною розчину «б». Суміш зберігають у склянці з темного скла. Реактив повинен бути безбарвним. Допускається слабко-рожеве забарвлення, яке зникає при розведенні 1:40. Якщо забарвлення не зникає, то реактив знебарвлюють цинковим пилом і для аналізу використовують відстояний безбарвний розчин. 5. Оцтова кислота, 12 %-вий розчин. Дистильованою водою розбавляють 25 мл крижаної оцтової кислоти до 200 мл. 6. Стандартні розчини NaNO2: а) головний стандартний розчин – у мірній колбі на 1 л у бідистильованій воді розчиняють 1,497 г висушеного при 1050 С нітриту натрію 7. Фотоелектроколориметр ЛМФ–72 М; кювети товщиною 2–5 см; зелений світлофільтр (l= 520 нм). 13.4.2. Якісне визначення вмісту У пробірку діаметром 13–14 мм наливають 10 мл досліджуваної води, додають декілька кристалів реактиву Грисса або 1 мл 10 % - вого розчину реактиву Грисса і нагрівають до 70 – 800 С на водяній бані. Через 10 хв. забарвлення, що з'явилося, порівнюють зі шкалою візуального визначення
вмісту нітрит–іонів (табл.13. 2). Таблиця 13.2. Орієнтовний вміст
13.4.3. Кількісне фотометричне визначення вмісту NO2 ¯ - іонів Виходячи з наближеної кількісної оцінки вмісту нітрит-іонів готують розчини для побудови градуювального графіка. Методика визначення 1. Приготування робочого розчину 1 мл головного стандартного розчину
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 160; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.116.159 (0.008 с.) |
 проводять фотометричним методом (с утність фотометричного методу аналізу наведена в 3.3.3.), згідно з ГОСТ 4192-82.
проводять фотометричним методом (с утність фотометричного методу аналізу наведена в 3.3.3.), згідно з ГОСТ 4192-82.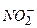 - іонів
- іонів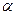 -нафтиламіну та сульфанілової кислоти в 12% -вому розчині оцтовій кислоті. Реакція протікає в дві стадії.
-нафтиламіну та сульфанілової кислоти в 12% -вому розчині оцтовій кислоті. Реакція протікає в дві стадії.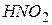 , що утворюється в кислому середовищі в присутності іонів
, що утворюється в кислому середовищі в присутності іонів  , взаємодіє з сульфаніловою кислотою з утворенням солі діазонію:
, взаємодіє з сульфаніловою кислотою з утворенням солі діазонію: 
 - нафтиламіном (реакція азосполучення) з утворенням азобарвника червоного кольору
- нафтиламіном (реакція азосполучення) з утворенням азобарвника червоного кольору 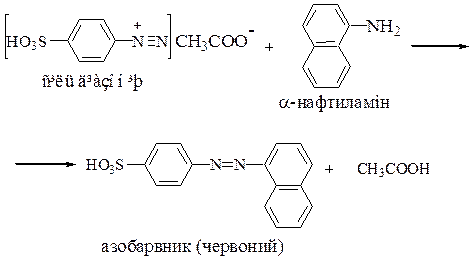
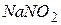 і доводять об’єм до позначки. В 1 мл міститься 1 мг NO2 -. Розчин консервують, додаючи 1 – 2 мл хлороформу; б) робочий розчин – 1 мл головного стандартного розчину
і доводять об’єм до позначки. В 1 мл міститься 1 мг NO2 -. Розчин консервують, додаючи 1 – 2 мл хлороформу; б) робочий розчин – 1 мл головного стандартного розчину 


