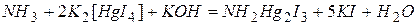Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фотометричним методом з роданідом
Сутність фотометричного методу аналізу для визначення концентрації розчинених речовин (іонів) наведена в 3.3.3. Визначення вмісту загального заліза з роданідом амонію (калію) фотометричним методом засновано на здатності іонів тривалентного заліза утворювати з роданід - іоном ряд комплексних сполук червоного кольору. При поступовому додаванні роданистого амонію (калію) до розчину заліза (111) спочатку відбувається наступна реакція: Fe3+ + При подальшому збільшенні концентрації роданід - іонів відбувається утворення комплексів з більшою кількістю координованих груп, причому максимальне їхнє число дорівнює шести:
Fe3+ + 6 SCN - = [ Fe(SCN)6 ] 3- Інтенсивність забарвлення комплексів з різною кількістю координованих роданід - іонів неоднакова; вона тим більша, чим більше роданід - іонів утримується в комплексній групі. Тому дуже важливо, щоб концентрація роданіду була досить великою і строго однаковою як в аналізованому, так і в стандартному (еталонному розчині). Необхідно, щоб розчин був помітно кислим, тому що при збільшенні pН має місце гідроліз солей заліза й утворення основних солей або гідроксидів. У цьому випадку забарвлення при додаванні роданід - іона може зовсім не з'явитися. Хід визначення загального вмісту заліза (III) 1. Побудова градуювального графіка З головного стандартного розчину заліза (III), що містить 0,1 мг заліза в 1 мл розчину, готують робочий розчин, що містить 0,005 мг заліза (III) в 1 мл розчину. Потім у 7 мірних колб місткістю 50 мл послідовно додають 0,2– 0, 5– 1–2–5 – 10–20 мл робочого розчину заліза (1 мл розчину містить 0,005 мг заліза). До кожної проби додають по 2 мл хлороводневої кислоти (1:1) і 50%-вого розчину роданіду амонію (калію) і дистильованою водою доводять до позначки. Отримані в такий спосіб розчини мають концентрацію заліза (III) відповідно 0,02–0,05– 0,1– 0,2– 0,5– 1–2 мг/л. Усі розчини забарвлюються в червоний колір різної інтенсивності, пропорційно концентрації заліза (III). Через 5 хв. проводять фотометричне визначення заліза, використовуючи синій світлофільтр (λ = 490‑508 нм) і кювету товщиною 1 см. За розчин порівняння беруть дистильовану воду. Для побудови градуювального графіка на осі ординат відкладають значення оптичної густини відповідних розчинів, а на осі абсцис - відповідні їм величини концентрацій заліза (III).
Визначення вмісту загального заліза у воді При загальному вмісті заліза у воді до 3 мг/л, визначення заліза виконують без розведення проби дистильованою водою. В мірну колбу місткістю 50 мл наливають ≈ 20–30 мл досліджуваної води, додають 2 мл розчину хлороводневої кислоти (1:1), кілька кристалів персульфату амонію (для окислення Fe (II) в Fe (III) і інтенсивно перемішують протягом 3 хв. Потім додають 2 мл розчину роданіду амонію (калію), знову перемішують і через 3 хв. фотометрують. За градуювальним графікомзнаходять загальний вміст заліза у воді. 3. Визначення вмісту заліза (III) Вміст Fe (III) у воді визначають аналогічно (див. пункт 2.), але без додавання персульфату амонію. 4. Визначення вмісту заліза (II) Вміст Fe (II) знаходять, віднімаючи з загального вмісту заліза (пункт 2) вміст Fe (III) (пункт 3).
Лабораторна робота 1 3 Визначення вмісту мінеральних азотовміщуючих речовин у воді 1 3.1. Самостійна підготовка Проробити такі питання: 1. Що є джерелом сполук азоту в природних водах? 2. Які неорганічні форми азоту можуть бути присутніми у воді і як вони характеризують ступінь забруднення води? 3. Як впливає підвищений вміст нітратів на організм людини? 1 3.2. Загальні відомості Іони Розчинений у воді аміак при окисненні киснемо повітря під впливом бактерій Nitrosomonas і Nitrobacter поступово перетворюється в азотисту, а потім азотну кислоту:
2 NH3 + 3 O2 = 2 HNO2 + 2 H2O 2 HNO2 + O2 = HNO3 Перша стадія окиснення протікає значно швидше, ніж друга. За наявністю у воді тієї чи іншої форми азоту, можна судити про момент забруднення води: наявність у воді аміаку (амонійного азоту) і відсутність нітритів свідчить про недавнє забруднення; спільна їх наявність – про те, що з моменту забруднення пройшов певний проміжок часу; відсутність аміаку за наявністю нітритів і особливо нітратів свідчить про те, що забруднення води відбулося давно і вода самовідновилася. Гранично припустима концентрація іонів NH4+ у воді 2,6 мг/л. Гранично припустима концентрація іонів Гранично припустима концентрація іонів 1 3.3. Визначення сумарного вмісту аміаку і NH4 + - іонів Посуд, реактиви, прилади 1. Пробірки діаметром 13–14 мм. 2. Колби місткістю 50 мл. 3. Піпетки місткістю 1, 2, 5, 50 мл. 4. Безаміачна вода. Усувають сліди аміаку фільтруванням дистильованої води крізь катіоніт у Н+ формі або активоване вугілля. Перевіряють на наявність аміаку реактивом Несслера. Безаміачна вода використовується для приготування стандартних розчинів і розведення проб. 5. Реактив Несслера: використовують готовий реактив Несслера або готують наступним чином –10 г іодида ртуті (II) розтирають з невеликою кількістю дистильованої води, додають 5 г іодиду калію і охолоджений розчин лугу (20 г КОН в 50 мл дистильованої води), суміш переносять у мірну колбу на 100 мл і доводять до мітки дистильованою водою. 6. Сегнетова сіль (тартрат калію-натрію ( 7. Стандартні розчини хлориду амонію: а) г оловний розчин: хлорид амонію NH4Cl висушують до постійної маси при 100 – 105 0 С. Розчиняють 2,965 г солі в дистильованій безаміачній воді в мірній колбі на 1 л і доводять об'єм до позначки тією ж водою, додають 2 мл хлороформу. Вміст іонів амонію: 1 мг/мл. б) Робочий розчин. Розбавляють 5 мл основного розчину в мірній колбі місткістю 100 мл безаміачною водою до мітки. Вміст іонів амонію в розчині 0,05 мг/мл. Робочий розчин застосовують свіжоприготовленим. 8. Фотоелектроколориметр ЛМФ-72 М; кювети товщиною 2–5 см (залежно від концентрації аміаку); фіолетовий світлофільтр (l= 400–425 нм). Визначення проводять відразу ж після відбору проби, або пробу зберігають при 3-4 0 С, або додають 1 мл H2SO4 на 1 л проби, або 2-4 мл хлороформу на 1л. Визначення аміаку та іонів Принцип методу визначення аміаку та іонів При вмісті аміаку у воді до 2 мг/л розчин забарвлюється в жовтий колір, а при більших – з'являється бурий осад. Інтенсивність забарвлення розчину пропорційна концентрації аміаку й іонів амонію, вимірюється на фотоколориметрі при довжині хвилі 400–425 нм. Чутливість методу 0,05 мг/л.
Сегнетову сіль додають для запобігання утворення й випадіння осаду Mg(OH)2 (іони Мg2+ присутні у воді, а іони ОH - вводяться у воду з реактивом Несслера). Якісне визначення Хід визначення. В пробірку діаметром 13-14 см наливають 10 мл досліджуваної води, додають 0, 2– 0,3 мл 50% – вого розчину сегнетової солі й 0,2 мл реактиви Несслера. Через 10–15 хв. проводять приблизне визначення за табл. 13.1. Таблиця 13.1. Орієнтовний вміст азоту аміаку і NH4 +
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 126; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.93.221 (0.009 с.) |
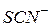 = [ FeSCN ] 2+
= [ FeSCN ] 2+ ,
, 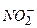 ,
,  утворюються у воді головним чином у результаті розкладання білкових сполук, які потрапляють у водойми зі стічними побутовими й промисловими водами. Білкові сполуки під впливом мікроорганізмів розкладаються до кінцевого продукту – аміаку. Тому наявність аміаку завжди є свідоцтвом забруднення води побутовими стічними водами – така вода не придатна для питних цілей. Амонійний азот може бути мінерального (при відновленні неорганічних азотистих сполук) і рослинного (при гнитті рослинних залишків) походження.
утворюються у воді головним чином у результаті розкладання білкових сполук, які потрапляють у водойми зі стічними побутовими й промисловими водами. Білкові сполуки під впливом мікроорганізмів розкладаються до кінцевого продукту – аміаку. Тому наявність аміаку завжди є свідоцтвом забруднення води побутовими стічними водами – така вода не придатна для питних цілей. Амонійний азот може бути мінерального (при відновленні неорганічних азотистих сполук) і рослинного (при гнитті рослинних залишків) походження. у воді 3,3 мг/л.
у воді 3,3 мг/л.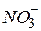 у воді 45 мг/л.
у воді 45 мг/л.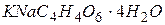 ), 50% розчин. У безаміачній воді при нагріванні розчиняють 500 г сегнетової солі, доводять об'єм до 1 л і фільтрують. Додають 5– 10 мл реактиву Несслера. Після освітлення і перевірки на повноту осадження аміаку реактив придатний до вживання.
), 50% розчин. У безаміачній воді при нагріванні розчиняють 500 г сегнетової солі, доводять об'єм до 1 л і фільтрують. Додають 5– 10 мл реактиву Несслера. Після освітлення і перевірки на повноту осадження аміаку реактив придатний до вживання. у воді проводять згідно з ГОСТ 4192-82.
у воді проводять згідно з ГОСТ 4192-82.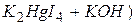 в присутності сегнетової солі (KNa4H4O6 · 4H2O) забарвлені в жовтий колір сполуки їодиду меркурамонію:
в присутності сегнетової солі (KNa4H4O6 · 4H2O) забарвлені в жовтий колір сполуки їодиду меркурамонію: