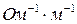Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тоді, беручи до уваги рівняння (11.4)
ǽ Якщо Електропровідність розчинів суттєво залежить від температури. Підвищення температури на 1 К призводить до зростання питомої електропровідності на 2‑2,5%. Це пов’язано зі зменшенням в’язкості розчину, гідратації іонів і зростанням ступеню дисоціації слабкого електроліту. Залежність питомої електропровідності ǽ розбавлених розчинів від температури визначена емпірично і має вигляд рівняння ǽ де ǽ - питома електропровідність при 298 К; Коефіцієнти 11.3. Робота в лабораторії Прилади, посуд і реактиви 1. Прилад для вимірювання опору. 2. Кондуктометрична комірка. 3. Мірні колби місткістю 100 мл. 4. Піпетки ємкістю 5, 10, 20, 25, 50 мл. 5. Стандартний 0,02М розчин 6. Робочий розчин із солевмістом 3 г/л.
У водах, до складу яких входять переважно неорганічні сполуки (більшість поверхневих вод), питома електропровідність є приблизним показником концентрації неорганічних електролітів. Мета роботи – засвоїти методику визначення питомої електропровідності з метою оцінки солевмісту води. Порядок вимірювання питомої електропровідності Безпосередньо в прямій кондуктометрії виміряють не питому електропровідність, а електричний опір досліджуваного розчину (
Методика виконання роботи 1. Визначення сталої кондуктометричної комірки Електричний опір ( ǽ тоді стала комірки Стала комірки – індивідуальна характеристика кожної комірки. Для її визначення достатньо виміряти опір розчину будь-якої речовини, питома електропровідність якого відома за умов різних температур. Зазвичай для визначення сталої комірки використовують стандартний 0,02М розчин Таблиця 11.1. Питома електропровідність 0,02М розчину
Очевидно, що тоді Практично сталу комірки визначають таким чином: суху й чисту комірку заповнюють 0,02М розчином 2. Приготування серії стандартних розчинів з відомим солевмістом і визначення їх питомої електропровідності Для приготування серії стандартних розчинів використовують вихідний робочий розчин з солевмістом 3 г/л. Стандартні розчини готують у мірних колбах на 100 мл шляхом розведення вихідного розчину в співвідношеннях 1:0; 1:1; 1:3; 1:4; 1: 7; 1: 9. Таким чином одержують 6 стандартних розчинів (з урахуванням вихідного робочого розчину) з концентраціями 3,0; 1,5; 0,75; 0,6; 0,375; 0,3 г/л відповідно.
Для кожного з 6 розчинів вимірюють опір (перед кожним виміром електроди ретельно промивають дистильованою водою –кількаразовим занурюванням і тільки після того, як вода стече з них, занурюють у вимірювальну комірку!). Питому електропровідність обчислюють за формулою ǽ Результати вимірів і обчислень занотовують до табл. 11.2. За даними таблиці будують градуювальний графік у координатах ǽ 3. Визначення солевмісту досліджуваної води Виміряють опір води, що досліджують, обчислюють питому електропровідність і за градуювальним графіком знаходять солевміст. Результати занотовують до табл. 11.2. Таблиця 12.3. Результати вимірів і обчислень
Слід підкреслити, що визначений солевміст води, що досліджують, повинен співпадати або бути близьким до підсумкової концентрації неорганічних солей (мг/л), яка була розрахована за сумою результатів окремих визначень кожного іону. Лабораторна робота № 12 Визначення вмісту загального заліза
Самостійна робота Проробити такі питання 1. У вигляді яких сполук знаходиться залізо в природних водах? 2. Який гранично припустимий вміст заліза у воді, придатної для питних цілей? 3. До чого приводити надлишковий вміст заліза у воді? 4. Якими методами може бути визначений вміст заліза у воді? 5. У чому полягає сутність фотометричного аналізу? 6. Що таке стандартні й нульові розчини? 7. Як будують калібрований графік, у чому його призначення?
Загальні положення Залізо постійно міститься в поверхневих і підземних водах у вигляді іонів Fe2+ і Fe3+. Підвищений вміст заліза у воді надає їй буре забарвлення і залізистий присмак. Крім того, наявність у воді солей заліза (II) сприяє розвитку залізистих бактерій, колонії яких, а також продукти їхньої життєдіяльності забивають каналізаційні труби. Згідно з ГОСТ 2874–82 гранично припустима концентрація заліза в питній воді не повинна перевищувати 0,3 мг/л, у воді водоймищ - 0,5 мг/л. Робота в лабораторії
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 126; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.161.222 (0.015 с.) |
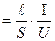 . (11.6)
. (11.6)  = 1 м2,
= 1 м2,  = 1м і
= 1м і  = 1 В, то очевидно, що фізичний сенс питомої електропровідності ǽ – це електропровідність, яка чисельно дорівнює силі струму
= 1 В, то очевидно, що фізичний сенс питомої електропровідності ǽ – це електропровідність, яка чисельно дорівнює силі струму  , що проходить крізь шар розчину з поперечним перерізом 1м2, при дії градієнту потенціалу 1 В на одиницю довжини.
, що проходить крізь шар розчину з поперечним перерізом 1м2, при дії градієнту потенціалу 1 В на одиницю довжини. = ǽ
= ǽ 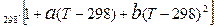 , (11.7)
, (11.7)  і
і 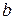 - температурні коефіцієнти електропровідності.
- температурні коефіцієнти електропровідності.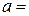 0,019; для солей
0,019; для солей 
 .
.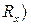 . Це проводиться компенсаційним методом - методом компенсації невідомої величини опору досліджуваного розчину опором, що виставляють на магазині опорів. Опір розчину виміряють за допомогою змінного струму високої частоти. При використанні постійного струму виникає електроліз розчину та поляризація електродів, що різко змінює опір розчину. Застосовують платинові електроди з великою активною поверхнею, для цього на платинову поверхню електродів додатково наносять шар пухкої аморфної платини.
. Це проводиться компенсаційним методом - методом компенсації невідомої величини опору досліджуваного розчину опором, що виставляють на магазині опорів. Опір розчину виміряють за допомогою змінного струму високої частоти. При використанні постійного струму виникає електроліз розчину та поляризація електродів, що різко змінює опір розчину. Застосовують платинові електроди з великою активною поверхнею, для цього на платинову поверхню електродів додатково наносять шар пухкої аморфної платини.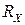 ) виміряють за допомогою кондуктометричної комірки – скляної посудини з впаяними платиновими електродами. Відстань між електродами (
) виміряють за допомогою кондуктометричної комірки – скляної посудини з впаяними платиновими електродами. Відстань між електродами (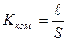 ), що отримало назву сталої кондуктометричної комірки, можна визначити експериментально. Відомо, що питома електропровідність
), що отримало назву сталої кондуктометричної комірки, можна визначити експериментально. Відомо, що питома електропровідність 
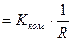 ,
,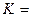 ǽ
ǽ 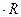 (м-1). (11.8)
(м-1). (11.8)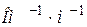 ) при різних температурах
) при різних температурах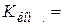 ǽ
ǽ 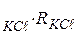 . (11.9)
. (11.9)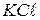 до певної позначки. Фіксують температуру розчину і методом компенсації тричі виміряють опір розчину. Різниця між паралельними вимірами не повинна бути більшою за 2–3 Ом. Для розрахунків беруть середнє значення опору. Користуючись даними табл. 11.1 за допомогою рівняння (11.9) розраховують сталу комірки.
до певної позначки. Фіксують температуру розчину і методом компенсації тричі виміряють опір розчину. Різниця між паралельними вимірами не повинна бути більшою за 2–3 Ом. Для розрахунків беруть середнє значення опору. Користуючись даними табл. 11.1 за допомогою рівняння (11.9) розраховують сталу комірки.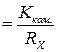 (11.10)
(11.10) – С (г/л).
– С (г/л).