
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення вмісту хлорид-іонів у воді методом Мора
Самостійна підготовка Проробити такі питання: 1. Які умови випадіння осадів? 2. Чим зумовлене використання K 2 CrO 4 в якості індикатору в методі Мора? 3. Який порядок випадіння осадів при титруванні хлорид-іонів розчином нітрату срібла в присутності хромату калію. Загальні положення Хлорид–іони, внаслідок своєї високої розчинності, завжди присутні в природних водах. Вони зумовлюють солоність морських і океанічних вод, а за своїм вмістом у прісних водоймах хлориди посідають третє місце після гідрокарбонат – і сульфат–іонів. Кількісно визначення хлорид-іонів здійснюють методом Мора, згідно з ГОСТ 4245-72.
Робота в лабораторії Посуд, матеріали, реактиви 1. Піпетки місткістю 100, 50, 10, 1 мл. 2. Бюретки місткістю 25 мл. 3. Колби конічні місткістю 250 мл – 2 шт. 4. Крапельниця з фенолфталеїном. 5. Колориметрична пробірка. 6. 0,05М розчин 7. Суспензія гідроксиду амонію. 8. 5-%- вий розчин 9. 10%-вий розчин 10. 0,1М розчин
10.3. Якісне визначення хлорид-іонів У колориметричну пробірку наливають 5 мл води і додають три краплини 10%–вого розчину нітрату срібла. Приблизний вміст хлорид-іонів визначають за характером осаду або каламутності у відповідності до вимог табл.(12.1). Таблиця 10.1. Приблизне кількісне визначення хлорид-іонів
10.4. Кількісне визначення хлорид-іонів Кількісне визначення хлорид-іонів здійснюють аргентометричним методом Мора, який ґрунтується на утворенні в нейтральному або слабко лужному середовищі (рН= 6 –10) малорозчинного осаду хлориду срібла (ДР = 1,78∙ 10-10)
Для встановлення кінця титрування використовують індикатор - хромат калію
Можливість титриметричного визначення хлоридів у присутності хромат-іонів пояснюється тим, що осад хлориду срібла менш розчинний, ніж осад хромату срібла
Очевидно, що бурий осад хромату срібла почне утворюватися тільки після того, коли повністю випаде осад хлориду срібла. Метод Мора застосовують для визначення хлоридів у воді з концентрацією понад 2 мг/л. Без додаткового розбавлення можна титрувати проби води з концентрацією хлоридів до 100 мг/л. Визначенню хлоридів заважають сульфіти, сульфіди та тіосульфати, які можна розкласти пероксидом водню в лужному середовищі. Фосфат–іони заважають при концентрації понад 25 мг/л, іони заліза – при концентрації більше 10 мг/л. Методика визначення Якщо вода каламутна, її фільтрують крізь беззольний фільтр, промитий гарячою водою. Якщо вода має кольоровість вище 300, пробу знебарвлюють додаванням гідроксиду амонію. Для цього до 200 мл проби додають 6 мл суспензії гідроксиду амонію і збовтують суміш до знебарвлення рідини. Потім пробу фільтрують крізь беззольний фільтр. Перші порції фільтру відкидають. Залежно від результатів якісного визначення відбирають у конічну колбу 100 мл досліджуваної води (або менший її об’єм – 10–15 мл) і доводять до 100 мл дистильованою водою. Без розведення визначають хлориди в концентрації до 400 мг/л. рН проби води повинно бути в межах 6,5–10. Якщо рН води невідоме, то необхідно додати 2 краплини фенолфталеїну (рТ = 9). При появі рожевого забарвлення прилити по краплях 0,1 М розчин H2SO4 до знебарвлення. В разі відсутності забарвлення необхідно нейтралізувати пробу води 0,1 М розчином NaOH до появи рожевого забарвлення, що зникає при збовтуванні. Відміряний об’єм води вносять до двох конічних колб і додають по 1 мл розчину індикатора K2CrO4. Одну пробу титрують робочим розчином нітрату срібла до зміни жовто-цитринного забарвлення на цеглисто-червоне, а другу використовують як контрольну пробу. При значному вмісті хлоридів утворюється осад Вміст хлорид–іону (мг/л) обчислюють за формулою
де
Згідно з ГОСТ 2874-82 вміст хлорид-іонів у питній воді не повинен перевищувати 350 мг/л. Розбіжність між результатами повторних визначень при вмісті
Лабораторна робота № 11 Кондуктометричний метод визначення солевмісту води
11.1. Самостійна підготовка Проробити такі питання: кондуктометричний метод аналізу, питома й еквівалентна електропровідність, їх зв’язок, вплив на провідність розчинів концентрації електролітів і температури, рухливість іонів, стала кондуктометричної комірки, солевміст води. 11.2. Сутність кондуктометричного методу аналізу Кондуктометричний метод аналізу ґрунтується на вимірюванні електропровідності розчинів. Електропровідність розчину зумовлена наявністю в ньому іонів. Здатність розчинів електролітів проводити електричний струм під впливом електричного поля характеризує електропровідність (
У системі СІ величина Ом-1 має назву сименс (См). Відомо, що електричний опір де r - питомий опір, Ом·м;
S - площа поперечного перерізу провідника, м2. Величину(ǽ) зворотну питомому опору ( ǽ Беручи до уваги рівняння (11.2), вираз для питомої електропровідності набуває вигляду
ǽ
Її вимірюють в Згідно з законом Ома і беручи до уваги рівняння (11.2) де
|
|||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 431; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.11.34 (0.01 с.) |
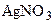 .
.
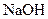 і 0,1 н. розчин
і 0,1 н. розчин  .
.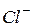 , мг/л
, мг/л


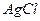 ¯
¯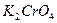 , який з надлишком іонів срібла утворює цеглисто–червоний осад хромату срібла (ДР = 1,1 ∙ 10-12)
, який з надлишком іонів срібла утворює цеглисто–червоний осад хромату срібла (ДР = 1,1 ∙ 10-12)
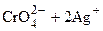
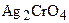 ¯
¯ ;
;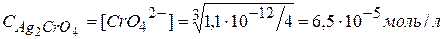 .
.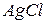 , що заважає визначенню. В цьому випадку до відтитрованої першої проби додають 2–3 краплини титрованого розчину
, що заважає визначенню. В цьому випадку до відтитрованої першої проби додають 2–3 краплини титрованого розчину 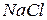 до зникнення цеглисто-червоного відтінку, потім титрують іншу пробу, користуючись першою як контрольною.
до зникнення цеглисто-червоного відтінку, потім титрують іншу пробу, користуючись першою як контрольною. ,
,  – молярна концентрація
– молярна концентрація  – об’єм розчину
– об’єм розчину 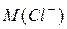 – молярна маса хлорид – іона, що дорівнює 35,45 г/моль;
– молярна маса хлорид – іона, що дорівнює 35,45 г/моль;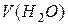 – об’єм проби води, взятий для титрування, мл.
– об’єм проби води, взятий для титрування, мл.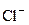 від 20 до 200 мг/л – 2 мг/л, при більш високому вмісті – 2 відн. %.
від 20 до 200 мг/л – 2 мг/л, при більш високому вмісті – 2 відн. %.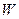 ). Значення електричної провідності розчину є зворотним до значення його електричного опору (
). Значення електричної провідності розчину є зворотним до значення його електричного опору ( , Ом)
, Ом)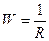 (Ом-1). (11.1)
(Ом-1). (11.1) r
r 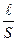 , (11.2)
, (11.2) - довжина провідника, м;
- довжина провідника, м; ) називають питомою електропровідністю
) називають питомою електропровідністю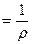 . (11.3)
. (11.3) 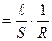 . (11.4)
. (11.4) 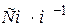 (або
(або  ) і вона дорівнює електричній провідності об’єму розчину, що знаходиться між паралельними електродами, які розташовані на відстані 1 м один від одного та мають площу поверхні 1
) і вона дорівнює електричній провідності об’єму розчину, що знаходиться між паралельними електродами, які розташовані на відстані 1 м один від одного та мають площу поверхні 1  . Більш зручною одиницею об’єму для практичного використання в лабораторних умовах є часткова одиниця виміру – кубічний сантиметр (
. Більш зручною одиницею об’єму для практичного використання в лабораторних умовах є часткова одиниця виміру – кубічний сантиметр (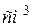 ). Тоді питома електропровідність буде вимірюватися в
). Тоді питома електропровідність буде вимірюватися в  (або
(або 
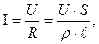 (11.5)
(11.5) 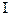 – сила струму, А;
– сила струму, А;  - напруга, В.
- напруга, В.


