| Нітратна кислота
| Ортофосфатна кислота
|
Молекулярна формула HNO3 молекул вона існує тільки в безводному стані або в парах.
Структурна формула:
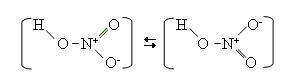 Валентність Нітрогену в нітратній кислоті дорівнює IV, а ступінь окиснення +5.
Валентність Нітрогену в нітратній кислоті дорівнює IV, а ступінь окиснення +5.
| У молекулі фосфатної кислоти атоми гідрогену сполучені з атомами оксигену:
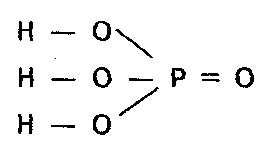 У водному розчині фосфатна кислота дисоціює ступінчасто. Як триосновна кислота, вона утворює солі — фосфати — трьох видів
Ступінь окиснення фосфору у кислоті +5
У водному розчині фосфатна кислота дисоціює ступінчасто. Як триосновна кислота, вона утворює солі — фосфати — трьох видів
Ступінь окиснення фосфору у кислоті +5
|
| Фізичні властивості.
Нітратна, або азотна кислота НNО3 – одна з найважливіших кислот.Безводна нітратна кислота –за звичайних умов є безбарвною рідиною, важчою за воду (p=1,513 г/см3). Вона летка і нестійка. Температура кипіння кислоти за нормального тиску становить 830С. Сполука змішується з водою в будь-яких співвідношеннях, утворюючи розчин.
Нітратна кислота є токсичною. Її концентрований розчин спричинює пожовтіння шкіри й опіки. ГДК парів НNО3 в повітрі становить 2 мг/м3.
| Фізичні властивості.
Фосфатна кислота — біла тверда речовина, з т. пл. 42,50С З водою змішується в будь-яких співвідношеннях. На відміну від нітратної кислоти не є окисником і не розкладається при нагріванні, що пояснюється найбільшою стійкістю ступеня окиснення +5 з усіх можливих для фосфору.
|
Хімічні властивості.
Розведена нітратна кислота має всі властивості кислот. Вона реагує з основами, солями, амфотерними гідроксидами, основними і амфотерними оксидами. Вона належить до сильних кислот. У водних розчинах дисоціює:
під дією теплоти і світла частково розкладається
Нітратна кислота належить до сильних одноосновних кислот. У водному розчині вона повністю дисоціює на йони:
1)дисоціація
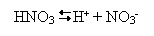 2)взаємодіє з основними оксидами та основами:
2)взаємодіє з основними оксидами та основами:
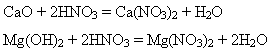 3)Взаємодіє з солями, з обмеженою кількістю солей, оскільки нітратна кислота хоч і сильна, але вона летка:
3)Взаємодіє з солями, з обмеженою кількістю солей, оскільки нітратна кислота хоч і сильна, але вона летка:
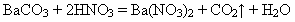 4)Розкладається під час нагрівання і під впливом світла:
4)Розкладається під час нагрівання і під впливом світла:
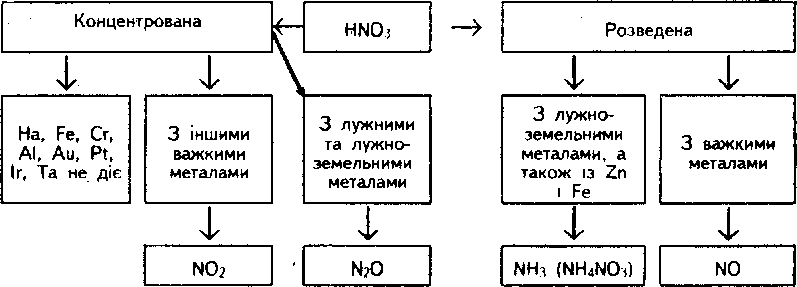
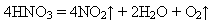 5)Взаємодіє з металами. Як сильний окисник нітратна кислота окиснює майже всі метали (за винятком золота, платини та ін.). При цьому водень не виділяється, бо відновлюється Нітроген, а не Гідроген. Лише магній може витіснити водень із нітратної кислоти, та й то на початку реакції, а далі він окиснюється з утворенням води. Нітроген відновлюється тим повніше, чим активніший метал і чим більше розбавлена кислота. Продукти відновлення можуть бути різні: NO2, NO, N2O, N2 або NH3, який з нітратною кислотою утворює сіль амоній нітрат. Тому зберігають її в прохолодному і темному місці.
Кислота ж, залежно від концентрації і активності металу, може відновлюватися до сполук:
+5 +4 +3 +2 +1 0 -3 -3
HNО3→NО2 →HNО2→ NО →N2О→ N2 → NH3 (NH4NО3).
Утворюється також сіль нітратної кислоти.
5)Взаємодіє з металами. Як сильний окисник нітратна кислота окиснює майже всі метали (за винятком золота, платини та ін.). При цьому водень не виділяється, бо відновлюється Нітроген, а не Гідроген. Лише магній може витіснити водень із нітратної кислоти, та й то на початку реакції, а далі він окиснюється з утворенням води. Нітроген відновлюється тим повніше, чим активніший метал і чим більше розбавлена кислота. Продукти відновлення можуть бути різні: NO2, NO, N2O, N2 або NH3, який з нітратною кислотою утворює сіль амоній нітрат. Тому зберігають її в прохолодному і темному місці.
Кислота ж, залежно від концентрації і активності металу, може відновлюватися до сполук:
+5 +4 +3 +2 +1 0 -3 -3
HNО3→NО2 →HNО2→ NО →N2О→ N2 → NH3 (NH4NО3).
Утворюється також сіль нітратної кислоти.
 Згідно зі схемою, концентрована нітратна кислота з важкими металами має відновлюватися до NO2;крім того, будуть утворюватися Н2О та сіль AgN03. Запишемо схему реакції:
Ag + 2HNO3(конц.) → AgN03+ NO2+ Н2О.
Розведена нітратна кислота при взаємодії зі сріблом (важким металом) відновлюється до NO і утворюються вода і сіль AgN03:
3Ag+ 4HNO3(розв.) → 3AgN03+ NO + 2Н2О;
Ще приклад: досить активний метал цинк залежно від концентрації нітратної кислоти може відновлювати її до оксиду нітрогену(І) N2O,вільного азоту N2 і навіть до аміаку NH3, який з надлишком нітратної кислоти дає нітрат амонію NH4NO3.
4Zn + 10HNO3(дуже розв.)= 4Zn (NО3)2 + NH4NO3+ 3Н2О;
Слід мати на увазі, що концентрована нітратна кислота за звичайної температури не взаємодіє з алюмінієм, хромом та залізом.
Нітратна кислота не реагує з Pt, Rh, Іг, Та, Au. Платина і золото розчиняються у "царській водці" — суміші 3 об'ємів концентрованої хлоридної кислоти і 1 об'єму концентрованої нітратної кислоти.
Нітратна кислота взаємодіє з багатьма неметалами, окиснюючи їх до відповідних кислот. Наприклад:
S + 2HNО3= H2SO4+ 2NO;
3Р + 5HNО3+ 2Н2О = 3Н3РО4 + 5NO;
В + 3HNО3= НзВОз + 3NО2;
С + 4HNО3= СО2 + 2Н2О + 4NО2.
Взаємодія з солями.
СаСО3 +2HNО3= Са (NО3)2 + СО2 ↑+ Н2О
Вона також взаємодіє з органічними сполуками. Нітруванням останніх добувають вибухові речовини, органічні барвники, ліки.
Взаємодіє з органічними речовинами:
а) реакції нітрування:
Згідно зі схемою, концентрована нітратна кислота з важкими металами має відновлюватися до NO2;крім того, будуть утворюватися Н2О та сіль AgN03. Запишемо схему реакції:
Ag + 2HNO3(конц.) → AgN03+ NO2+ Н2О.
Розведена нітратна кислота при взаємодії зі сріблом (важким металом) відновлюється до NO і утворюються вода і сіль AgN03:
3Ag+ 4HNO3(розв.) → 3AgN03+ NO + 2Н2О;
Ще приклад: досить активний метал цинк залежно від концентрації нітратної кислоти може відновлювати її до оксиду нітрогену(І) N2O,вільного азоту N2 і навіть до аміаку NH3, який з надлишком нітратної кислоти дає нітрат амонію NH4NO3.
4Zn + 10HNO3(дуже розв.)= 4Zn (NО3)2 + NH4NO3+ 3Н2О;
Слід мати на увазі, що концентрована нітратна кислота за звичайної температури не взаємодіє з алюмінієм, хромом та залізом.
Нітратна кислота не реагує з Pt, Rh, Іг, Та, Au. Платина і золото розчиняються у "царській водці" — суміші 3 об'ємів концентрованої хлоридної кислоти і 1 об'єму концентрованої нітратної кислоти.
Нітратна кислота взаємодіє з багатьма неметалами, окиснюючи їх до відповідних кислот. Наприклад:
S + 2HNО3= H2SO4+ 2NO;
3Р + 5HNО3+ 2Н2О = 3Н3РО4 + 5NO;
В + 3HNО3= НзВОз + 3NО2;
С + 4HNО3= СО2 + 2Н2О + 4NО2.
Взаємодія з солями.
СаСО3 +2HNО3= Са (NО3)2 + СО2 ↑+ Н2О
Вона також взаємодіє з органічними сполуками. Нітруванням останніх добувають вибухові речовини, органічні барвники, ліки.
Взаємодіє з органічними речовинами:
а) реакції нітрування:
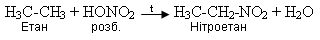
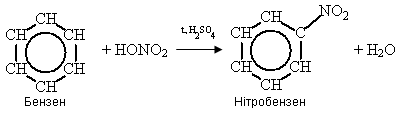
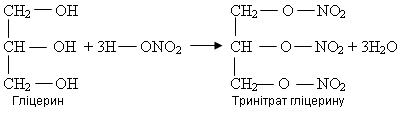
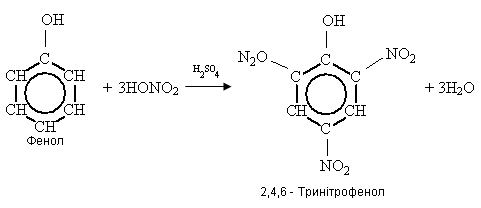 б) реакція етерифікації:
б) реакція етерифікації:
 в) ксантопротеїнова реакція на білки. Нітратна кислота роз’їдає тканини, спричинює жовті плями на шкірі і виразки
в) ксантопротеїнова реакція на білки. Нітратна кислота роз’їдає тканини, спричинює жовті плями на шкірі і виразки
| Хімічні властивості.
Взаємодія з металами.
Фосфатна кислота, на відміну від нітратної, окисні властивості виявляє набагато слабше, тому реагує тільки з активними металами, утворюючи сіль і водень:
3Mg + 2H3PO4 = Mg2(PO4)2 ↓+ 3H2↑
Фосфат магнію – нерозчинна сіль, викликає пасивацію металу, і реакція припиняється. А в надлишку кислоти реакція відбувається, але з утворенням кислої солі:
Mg + 2H3PO4 = Mg(Н2PO4)2 ↓+ 3H2↑
Взаємодія з основами.
Кислота реагує зі сполуками основної та амфотерної природи (оксидами, гідроксидами) з утворенням солей – ортофосфатів. Під час таких реакцій можуть утворюватися не тільки середні солі
3NaOH+H3PO4=Na3PO4+3H2O
а й кислі – гідроген фосфати, дигідрогенфосфати:
2NaOH+H3PO4(надл)=Na2НPO4+2H2O
NaOH+H3PO4(надл)=NaН2PO4+H2O
Взаємодія з солями.
Оскільки H3PO4 - кислота середньої сили й нелетка, то з нею реагують солі слабких, летких, нестійких кислот – карбонатної, сульфідної, оцтової та ін.:
Na2СО3+ 2H3PO4(надл) =2NaН2PO4+СО2+Н2О
|
| Добування нітратної кислоти.
У лабораторних умовах нітратну (азотну) кислоту добувають з її солей дією концентрованої сульфатної кислоти:
KNO3+ H2SO4(к)= HNO3+ KHSO4.
Реакція відбувається при слабкому нагріванні (сильне нагрівання розкладає HNO3). Суміш речовин нагрівають в установці для перегонки. HNO3 виділяється у вигляді пари, яка при охолодженні конденсується.
У промисловості нітратну кислоту добувають каталітичним окисненням аміаку, який, у свою чергу, утворюється при сполученні водню і азоту повітря. Відкриття промислового способу окиснення аміаку до нітратної кислоти належить інженеру-хіміку І. І. Андрєєву — засновнику азотної промисловості в Росії. Він запропонував застосовувати при окисненні аміаку киснем повітря каталізатор — платинову сітку — і реалізував цей спосіб спочатку на дослідній установці в Макіївці (1916), а потім на заводі в Донецьку (колишній Юзовці) (1917).
Увесь процес добування нітратної кислоти можна розділити на три етапи:
1. окиснення аміаку на платиновому каталізаторі до NО;
4NH3+ 5О2 = 4NО + 6Н2О;
2. окиснення киснем повітря NО до NO2:
2NО + О2 = 2NО2;
3. поглинання NО2 водою при надлишку кисню:
4NО2+ 2Н2О + О2 = 4HNО3. (3NО2 + Н2О= 2HNО3+ NО)
Вихідні продукти — аміак і повітря — старанно очищають від шкідливих домішок, що отруюють каталізатор (сірководень, пил, масла тощо).
За цим способом утворюється розведена (40—60 %-ва) кислота. Концентровану нітратну кислоту (96—98 %-ву) добувають перегонкою розведеної кислоти у суміші з концентрованою сульфатною кислотою. При цьому випаровується тільки нітратна кислота.
Розведену нітратну кислоту зберігають і перевозять у тарі з хромистої сталі, концентровану — в алюмінієвій тарі. Невелику кількість її зберігають у скляних бутлях.
| Добування ортофосфатної кислоти.
У промисловості фосфатну кислоту добувають двома способами: екстракційним і термічним.
За першим способом подрібнений фосфат кальцію обробляють сульфатною кислотою:
Са3(РО4)2 + 3H2SO4= 2Н3РО4 + 3CaSО4↓.
CaSО4випадає у вигляді осаду, а кислота залишається в розчині. Разом з кислотою в розчин переходить багато домішок — сульфати феруму, алюмінію та ін. Така кислота використовується при виробництві добрив.
Другим способом спочатку добувають фосфор (відновленням природного фосфору в електропечі). Далі його окиснюють до оксиду Р2О5, а останній сполучають з водою і дістають чисту кислоту (концентрація до 80 %).
|
| Застосування. Азотна кислота — один з найважливіших продуктів основної хімічної промисловості. Велика кількість її витрачається на виробництво азотних добрив, вибухових речовин, лікарських речовин, барвників, пластичних мас, штучних волокон та інших матеріалів. Димляча нітратна кислота застосовується у ракетній техніці як окисник ракетного пали
| Застосування. Ортофосфатна кислота не отруйна і найбільш широко застосовується у виробництві мінеральних добрив, крім того, вона використовується у харчовій промисловості для виготовлення сиропів.
|
*напишіть рівняння реакції концентрованої та розбавленої нітратної кислоти з калієм,алюмінієм,залізом,міддю,кальцієм,барієм,сіркою,фосфором.
*Яку масу нітратної кислоти можна добути з 20,2 г калій нітрату при дії на нього надлишком сульфатної кислоти, якщо масова частка практичного виходу нітратної кислоти складає 0,98. (12,348 г)
*Яку масу розчину фосфатної кислоти з масовою часткою розчиненої речовини 65% можна одержати з кальцій фосфату масою 10 т, якщо масова частка практичного виходу складає 92%? (8,95 т)
*Яка маса фосфориту необхідна для виробництва 5 т фосфору, якщо масова частка виходу продукту реакції складає 96% від теоретично можливого? (26 т)
У водному розчині фосфатна кислота дисоціює ступінчасто. Як триосновна кислота, вона утворює солі — фосфати — трьох видів:
1) фосфати — заміщено всі атоми гідрогену у фосфатній кислоті, наприклад К3РО4 — фосфат калію, (NH4)3P04-т фосфат амонію;
2) гідрогенфосфати — заміщено два атоми гідрогену кислоти, наприклад К2НРО4 — гідрофосфат калію, (NH4)2HP04— гідрофосфат амонію;
3) дигідрогенфосфати — заміщений один атом гідрогену кислоти, наприклад КН2РО4 — дигідрофосфат калію, NH4H2PO4- дигідрофосфат амонію.
Усі фосфати лужних металів і амонію розчиняються у воді. З кальцієвих солей фосфатної кислоти розчиняється у воді лише дигідрофосфат кальцію. Гідрофосфат кальцію і фосфат кальцію розчинні в органічних кислотах (органічні кислоти є в підзолистих і торфових ґрунтах).
Класифікація добрив. Мінеральні добрива поділяють на прості (однобічні) і комплексні (складні та змішані).
Прості добрива містять один поживний елемент. Наприклад, натрієва селітра містить нітроген, а хлорид калію — калій і т. д.
Складні добрива в однорідних частинках містять два і більше поживних елементів. Наприклад, калійна селітра містить калій і нітроген, нітрофоска — нітроген, фосфор, калій і т. д.
Змішані добрива — це механічні суміші різних видів добрив — простих, складних або тих і інших. Вони часто називаються тукосумішами.
Мінеральні добрива часто називають туками, а промисловість, що їх виробляє,— туковою. Нині вона випускає понад 40 видів мінеральних добрив.
Найбільше значення мають азотні, фосфорні та калійні добрива. Найголовніші з них представлено в таблиці 1.
Азотні добрива містять зв'язаний азот. Це селітри (нітрати натрію, калію, амонію і кальцію), солі амонію, рідкий аміак, аміачна вода, сечовина CO(NH2)2(застосовується і як кормовий засіб для худоби, містить найбільше азоту — 47 %) та ін. Із цих добрив тепер найширше застосовується аміачна селітра, тобто нітрат амонію. Щоб він не злежувався, його випускають у гранульованому (зернистому) вигляді.
Фосфорні добрива — це кальцієві та амонійні солі фосфатної кислоти. Вони становлять половину всіх мінеральних добрив, що виробляються. Найпоширенішими фосфорними добривами є такі.
Фосфоритне борошно, яке добувають при тонкому розмелюванні фосфоритів. Оскільки воно містить малорозчинну сіль Са3(Р04)2, то засвоюватися рослинами може тільки на кислих ґрунтах — підзолистих і торф'яних. Засвоєнню сприяє м'якість помелу, а також внесення його в ґрунт разом з кислими добривами, наприклад з (NH4)2S04або гноєм.
Простий суперфосфат, який добувають обробкою апатитів і фосфоритів сульфатною кислотою. Мета обробки — добути розчинну сіль, що добре засвоюється рослинами у будь-якому ґрунті:
Са3(Р04)2 + 2H2SO4= Са(Н2Р04)2 + 2CaS04.
Суміш добутих солей Са(Н2Р04)2, і CaS04звичайно і називається простим суперфосфатом. Його виробляють у дуже великих кількостях як в гранульованому вигляді, так і у вигляді порошку.
Гранульоване добриво має ряд переваг порівняно з порошковим: його легше зберігати (не злежується); зручніше вносити у ґрунт за допомогою тукових сівалок, а головне — на більшості ґрунтів воно дає вищий приріст урожаю.
Подвійний суперфосфат — концентроване фосфорне добриво складу Са(Н2Р04)2. Порівняно з простим суперфосфатом не містить баласту — CaS04. Добування подвійного суперфосфату здійснюють у дві стадії. Спочатку добувають фосфатну кислоту. Потім водним розчином фосфатної кислоти обробляють апатит або фосфорит. Кількість вихідних продуктів беруть відповідно до рівняння:
Са3(РО4)2 + 4Н3РО4 = 3Са(Н2РО4)2
Преципітат — концентроване фосфорне добриво складу СаНРО4·2Н2О. Малорозчинний у воді, але добре розчиняється в органічних кислотах. Утворюється при нейтралізації фосфатної кислоти розчином гідроксиду кальцію: Н3РО4 + Са(ОН)2 = СаНРО4 ∙ 2Н2О.
Кісткове борошно, яке добувають переробкою кісток домашніх тварин, містить Са3(РО4)2.
Амофос — добриво, що містить фосфор і нітроген. Утворюється при нейтралізації фосфатної кислоти аміаком. Звичайно містить солі NH4H2PO4та (NH4)2НРО4.
Отже, фосфорними добривами є кальцієві та амонійні солі фосфатної кислоти.
Мінеральні добрива
| Назва
| Склад
|
| Азотні
|
| Амоній сульфат
| (NH4)2SO4
|
| Амоній нітрат
| NH4NO3
|
| Карбамід(сечовина)
| CO(NH2)2
|
| Аміачна селітра
| Водний розчин NH3
|
| Фосфорні
|
| Простий суперфосфат
| Суміш Са(Н2РО4)2Н2О і CaS042Н2О
|
| Подвійний суперфосфат
| Са(Н2РО4)2Н2О
|
| Преципітат
| СаНРО4 ∙ 2Н2О
|
| Кісткове борошно
| Са3(РО4)2
|
| Калійні
|
| Калій хлорид
| КСl
|
| Калій сульфат
| K2SO4
|
| Комбіновані (комплексні)
|
| Амофос
| NH4H2PO4і (NH4)2НРО4
|
| Калій нітрат
| КNO3
|


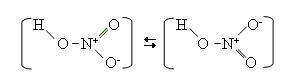 Валентність Нітрогену в нітратній кислоті дорівнює IV, а ступінь окиснення +5.
Валентність Нітрогену в нітратній кислоті дорівнює IV, а ступінь окиснення +5.
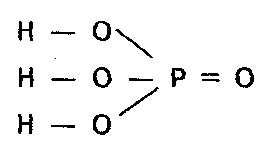 У водному розчині фосфатна кислота дисоціює ступінчасто. Як триосновна кислота, вона утворює солі — фосфати — трьох видів
Ступінь окиснення фосфору у кислоті +5
У водному розчині фосфатна кислота дисоціює ступінчасто. Як триосновна кислота, вона утворює солі — фосфати — трьох видів
Ступінь окиснення фосфору у кислоті +5
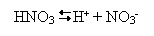 2)взаємодіє з основними оксидами та основами:
2)взаємодіє з основними оксидами та основами:
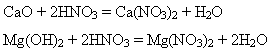 3)Взаємодіє з солями, з обмеженою кількістю солей, оскільки нітратна кислота хоч і сильна, але вона летка:
3)Взаємодіє з солями, з обмеженою кількістю солей, оскільки нітратна кислота хоч і сильна, але вона летка:
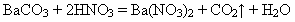 4)Розкладається під час нагрівання і під впливом світла:
4)Розкладається під час нагрівання і під впливом світла:
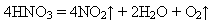 5)Взаємодіє з металами. Як сильний окисник нітратна кислота окиснює майже всі метали (за винятком золота, платини та ін.). При цьому водень не виділяється, бо відновлюється Нітроген, а не Гідроген. Лише магній може витіснити водень із нітратної кислоти, та й то на початку реакції, а далі він окиснюється з утворенням води. Нітроген відновлюється тим повніше, чим активніший метал і чим більше розбавлена кислота. Продукти відновлення можуть бути різні: NO2, NO, N2O, N2 або NH3, який з нітратною кислотою утворює сіль амоній нітрат. Тому зберігають її в прохолодному і темному місці.
Кислота ж, залежно від концентрації і активності металу, може відновлюватися до сполук:
+5 +4 +3 +2 +1 0 -3 -3
HNО3→NО2 →HNО2→ NО →N2О→ N2 → NH3 (NH4NО3).
Утворюється також сіль нітратної кислоти.
5)Взаємодіє з металами. Як сильний окисник нітратна кислота окиснює майже всі метали (за винятком золота, платини та ін.). При цьому водень не виділяється, бо відновлюється Нітроген, а не Гідроген. Лише магній може витіснити водень із нітратної кислоти, та й то на початку реакції, а далі він окиснюється з утворенням води. Нітроген відновлюється тим повніше, чим активніший метал і чим більше розбавлена кислота. Продукти відновлення можуть бути різні: NO2, NO, N2O, N2 або NH3, який з нітратною кислотою утворює сіль амоній нітрат. Тому зберігають її в прохолодному і темному місці.
Кислота ж, залежно від концентрації і активності металу, може відновлюватися до сполук:
+5 +4 +3 +2 +1 0 -3 -3
HNО3→NО2 →HNО2→ NО →N2О→ N2 → NH3 (NH4NО3).
Утворюється також сіль нітратної кислоти.
 Згідно зі схемою, концентрована нітратна кислота з важкими металами має відновлюватися до NO2;крім того, будуть утворюватися Н2О та сіль AgN03. Запишемо схему реакції:
Ag + 2HNO3(конц.) → AgN03+ NO2+ Н2О.
Розведена нітратна кислота при взаємодії зі сріблом (важким металом) відновлюється до NO і утворюються вода і сіль AgN03:
3Ag+ 4HNO3(розв.) → 3AgN03+ NO + 2Н2О;
Ще приклад: досить активний метал цинк залежно від концентрації нітратної кислоти може відновлювати її до оксиду нітрогену(І) N2O,вільного азоту N2 і навіть до аміаку NH3, який з надлишком нітратної кислоти дає нітрат амонію NH4NO3.
4Zn + 10HNO3(дуже розв.)= 4Zn (NО3)2 + NH4NO3+ 3Н2О;
Слід мати на увазі, що концентрована нітратна кислота за звичайної температури не взаємодіє з алюмінієм, хромом та залізом.
Нітратна кислота не реагує з Pt, Rh, Іг, Та, Au. Платина і золото розчиняються у "царській водці" — суміші 3 об'ємів концентрованої хлоридної кислоти і 1 об'єму концентрованої нітратної кислоти.
Нітратна кислота взаємодіє з багатьма неметалами, окиснюючи їх до відповідних кислот. Наприклад:
S + 2HNО3= H2SO4+ 2NO;
3Р + 5HNО3+ 2Н2О = 3Н3РО4 + 5NO;
В + 3HNО3= НзВОз + 3NО2;
С + 4HNО3= СО2 + 2Н2О + 4NО2.
Взаємодія з солями.
СаСО3 +2HNО3= Са (NО3)2 + СО2 ↑+ Н2О
Вона також взаємодіє з органічними сполуками. Нітруванням останніх добувають вибухові речовини, органічні барвники, ліки.
Взаємодіє з органічними речовинами:
а) реакції нітрування:
Згідно зі схемою, концентрована нітратна кислота з важкими металами має відновлюватися до NO2;крім того, будуть утворюватися Н2О та сіль AgN03. Запишемо схему реакції:
Ag + 2HNO3(конц.) → AgN03+ NO2+ Н2О.
Розведена нітратна кислота при взаємодії зі сріблом (важким металом) відновлюється до NO і утворюються вода і сіль AgN03:
3Ag+ 4HNO3(розв.) → 3AgN03+ NO + 2Н2О;
Ще приклад: досить активний метал цинк залежно від концентрації нітратної кислоти може відновлювати її до оксиду нітрогену(І) N2O,вільного азоту N2 і навіть до аміаку NH3, який з надлишком нітратної кислоти дає нітрат амонію NH4NO3.
4Zn + 10HNO3(дуже розв.)= 4Zn (NО3)2 + NH4NO3+ 3Н2О;
Слід мати на увазі, що концентрована нітратна кислота за звичайної температури не взаємодіє з алюмінієм, хромом та залізом.
Нітратна кислота не реагує з Pt, Rh, Іг, Та, Au. Платина і золото розчиняються у "царській водці" — суміші 3 об'ємів концентрованої хлоридної кислоти і 1 об'єму концентрованої нітратної кислоти.
Нітратна кислота взаємодіє з багатьма неметалами, окиснюючи їх до відповідних кислот. Наприклад:
S + 2HNО3= H2SO4+ 2NO;
3Р + 5HNО3+ 2Н2О = 3Н3РО4 + 5NO;
В + 3HNО3= НзВОз + 3NО2;
С + 4HNО3= СО2 + 2Н2О + 4NО2.
Взаємодія з солями.
СаСО3 +2HNО3= Са (NО3)2 + СО2 ↑+ Н2О
Вона також взаємодіє з органічними сполуками. Нітруванням останніх добувають вибухові речовини, органічні барвники, ліки.
Взаємодіє з органічними речовинами:
а) реакції нітрування:
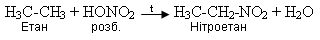

 б) реакція етерифікації:
б) реакція етерифікації:
 в) ксантопротеїнова реакція на білки. Нітратна кислота роз’їдає тканини, спричинює жовті плями на шкірі і виразки
в) ксантопротеїнова реакція на білки. Нітратна кислота роз’їдає тканини, спричинює жовті плями на шкірі і виразки



