

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Розвязування задач на визначення масової частки, об’єму та кількості речовини.
| І варіант
| ІІ варіант
| | 1. Обчисліть масу цинк карбонату, яку необхідно прожарити для одержання цинк оксиду масою 20,25 г
| 1. Яка кількість речовини кисню потрібна для добування 240 г магній оксиду з магнію?
| | . 2. Обчисліть об’єм вуглекислого газу, що виділяється при прожарюванні вапняку масою 1 кг.
| 2. Визначте масу солі, що утворюється при взаємодії натрій гідроксиду масою 80 г із розчином хлоридної кислоти.
| | 3. У воді масою 600 г розчинили аміак об’ємом 560 мл (н. у.). Визначте масову частку аміаку в отриманому розчині
| 3. У воді масою 400 г розчинили сірководень об’ємом 12 мл (н. у.). Визначте масову частку сірководню в отриманому розчині.
| Самостійна робота:
1. Під час пропускання карбон (IV) оксиду крізь розчин гідроксиду кальцію отримали гідрокарбонат кальцію масою 8,1 г. Визначте об’єм карбон (IV) оксиду.
2. До розчину масою 250 г, у якому масова частка солі становить 10%, долили воду об’ємом 150 мл. Визначте масову частку солі в отриманому розчин, вважаючи, що густина води дорівнює 1 г/мл.
3. Карбон (IV) оксид, отриманий під час спалення вугілля масою 50 г, пропустити крізь розчин гідроксиду барію. Яка маса осаду що утворився, якщо масова частка карбону у вугіллі становить 96%?
Розв’язування задач на надлишок
| І варіант
| ІІ варіант
| | 1. Цинк масою 32,5 г взаємодіє із сіркою масою 24 г. Яка маса цинк сульфіду утвориться? Яка речовина в надлишку? Визначте масу надлишку
| 1. Яку масу сульфур (IV) оксиду можна отримати з 10 г сірки і 5.6 л кисню (н.у.)?
| | . Сірководень об’ємом 5,6 л спалили в 11,2 л кисню. Які продукти утворяться в результаті реакції? Знайдіть маси продуктів реакції
| 2. Який об’єм аміаку утвориться з 6 л водню і 4 л азоту? Який газ залишиться у надлишку? Знайдіть об’єм надлишку.
| Самостійна робота:
1. До розчину сульфатної кислоти масою 60 г з масовою часткою 10% додали 80 г 15%-го розчину натрій гідроксиду. Розрахуйте масу солі, що утвориться.
2. До розчину масою 200 г з масовою часткою сульфатної кислоти 9,8% долили розчин натрій гідроксиду, що містив 16 г лугу. Обчисліть масу солі, що утворилась.
3. До 140 г розчину з масовою часткою купрум (ІІ) сульфату 16% додали 5,6 г порошкоподібного заліза. Обчисліть маси солей у розчині після закінчення реакції.
Розв’язування задач на вихід продукту реакції
| І варіант
| ІІ варіант
| | 1. Із сульфур (VI) оксиду масою 40 г було одержано 38,32 г сульфатної кислоти. Обчисліть вихід реакції
| 1. Яку масу сульфатної кислоти можна одержати з 40 г сульфур (VI) оксиду, якщо вихід реакції – 80%.
| | 2. Яку масу солі можна одержати з 24,5 г сульфатної кислоти і калій гідроксиду, якщо вихід реакції дорівнює 88%?
| 2. Яку масу сульфур (VI) оксиду необхідно взяти для одержання 73,5 г сульфатної кислоти, якщо вихід реакції 75%.
| Самостійна робота:
1. 90 г натрій карбонату повністю розчинилося в сульфатній кислоті, при цьому утворилося 15,2 л газу. Визначте вихід реакції.
2. Розрахуйте масу цинку, необхідного для одержання 10 л водню (н.у.) при реакції із сульфатною кислото, якщо вихід реакції 78%.
3. Пісок масою 2 кг сплавили з надлишком гідроксиду калію, отримавши внаслідок реакції силікат калію масою 3,82 кг. Визначте вихід продукту реакції, якщо масова частка силіцію (IV) оксиду становить 90%.
Оксиди неметалічних елементів.
Оксиди Сульфуру
| Сульфур(IV) оксид
| Сульфур(VI) оксид
| Молекулярна формула – SO2.
Структурна формула -
 Атоми в молекулі зв’язані ковалентними полярними зв’язками, що утворюють кут 120O.
Ступінь окиснення Сульфуру +4: S+4O2-2
Атоми в молекулі зв’язані ковалентними полярними зв’язками, що утворюють кут 120O.
Ступінь окиснення Сульфуру +4: S+4O2-2
| Молекулярна формула – SO3.
Структурна формула
 Атоми в молекулі зв’язані ковалентними полярними зв’язками. Молекула має будову площинного трикутника з кутом між зв’язками 120O.
Атоми в молекулі зв’язані ковалентними полярними зв’язками. Молекула має будову площинного трикутника з кутом між зв’язками 120O.
| | Фізичні властивості.
Сульфур(IV) оксид, сульфур діоксид, - безбарвний газ із різким запахом, що викликає кашель, у 2,2 рази важчий за повітря, дуже легко розчиняється у воді (в 1 л води при 20OC - 49 л оксиду).
| Фізичні властивості.
Сульфур(VI) оксид, або сульфур триоксид, - безбарвна рідина з температурою кипіння 45OC. За температури, нижчої від 17OC, кристалізується, перетворюючись на довгі шовковисті кристали. Дуже летка речовина, токсична, уражує слизові оболонки й дихальні шляхи, викликає тяжкі опіки, руйнує органічні сполуки. Зберігають у запаяних скляних посудинах (ампулах).
| | Хімічні властивості
Поряд з „фізичним” розчиненням одночасно відбувається хімічна взаємодія – приєднання молекул води (гідратація), внаслідок чого утворюється сульфітна кислота.
Водний розчин сульфур(IV) оксиду називається сульфітною кислотою, спрощена формула якої H2SO3.
Основна маса розчиненого сульфур(IV) оксиду перебуває в розчині у гідратованій формі: SO2 nH2O
1)невелика частка молекул розчиненого оксиду взаємодіє з водою за схемою:

2)Сульфур(IV) оксид - кислотний оксид. Він взаємодіє з основними оксидами і лугами:
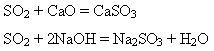
3)За наявності каталізатора приєднує кисень:

4)За наявності сильних відновників виявляє властивості окисника:

Сульфур(IV) оксид вбиває мікроорганізми, з органічними фарбами утворює безбарвні сполуки
| Хімічні властивості.
1)Сульфур(VI) оксид – на повітря димить, вбираючи вологу з повітря, бурхливо взаємодіє з водою:
SO3 + H2O = H2SO4
2)Сульфур(VI) оксид розчиняється у концентрованій сульфатній кислоті з утворенням олеуму, формула якого
 3)Виявляє загальні властивості, що характерні для кислотних оксидів:
3)Виявляє загальні властивості, що характерні для кислотних оксидів:
 4)Виявляє сильні окисні властивості, відновлюючись зазвичай до сульфур(IV) оксиду:
4)Виявляє сильні окисні властивості, відновлюючись зазвичай до сульфур(IV) оксиду:

| Добування.
У лабораторних умовах:
а) дією хлоридної або сульфатної кислоти на сульфіти:
 б) взаємодією концентрованої сульфатної кислоти з міддю під час нагрівання;
б) взаємодією концентрованої сульфатної кислоти з міддю під час нагрівання;
 У промисловості – прожарюванням цинк сульфіду:
У промисловості – прожарюванням цинк сульфіду:
 або прожарюванням піриту (залізного колчедану), який можна розглядати як ферум(ІІ) сульфід, що містить вільну сірку 4FeS2+11O2=2Fe2O3+8SO2
або прожарюванням піриту (залізного колчедану), який можна розглядати як ферум(ІІ) сульфід, що містить вільну сірку 4FeS2+11O2=2Fe2O3+8SO2
| Добування.
У промисловості:

| | Використання.
для добування сульфатної кислоти; вибілювання соломи, вовни, шовку; як дезинфікуючий засіб.
| Використання.
Використовують для добування сульфатної кислоти
|
*обчисліть густину сірчистого газу за н.у.У скільки цей газ важчий за повітря?
*здійсніть перетворення: S → SO2 → KHSO3 → K2SO3 → BaSO3 → SO2
Оксиди Нітрогену
Нітроген з Оксигеном утворює п’ять оксидів, в яких він виявляє різні ступені окиснення від +1 до +5. Різний кількісний склад оксидів і різна їх будова зумовлюють їх різні властивості. Усі оксиди Нітрогену дуже отруйні, за винятком нітроген(І) оксиду.
| Формула оксиду
| Ступінь окиснення Нітрогену
| Характер оксиду
| Агрегатний стан
| Колір
| Добування
| Застосування
| | N2O
| +1
| Несолетворний
| Газ
| Безбарвний
|

| Знеболюючий засіб у медицині, „звеселяючий” газ
| | NO
| +2
| Несолетворний
| Газ
| Безбарвний
| 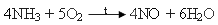
| Проміжний продукт виробництва нітратної кислоти
| | N2O3
| +3
| Кислотний
| Рідина
| Синій
| NO + NO2 = N2O3
| -
| | NO2
N2O4
| +4
| Кислотний
| Газ
Тверда ре
овина
| Бурий Безбарвний
| 2NO + O2 = 2 NO2
2NO2 N2O4
| Окисник рідкого ракетного палива; каталізатор; очисник нафтопродуктів
| | N2O5
| +5
| Кислотний
| Тверда речовина
| Білий
| 2HNO3 + P2O5= N2O5 + 2HPO3
| -
| |
Хімічні властивості.
Нітроген(ІІ) оксид на повітрі легко окиснюється і переходить у бурий газ:
2NO + O2 = 2NO2
Нітроген(ІІІ) оксид взаємодіє з водою з утворенням нітритної кислоти:
N2O3 + H2O = 2HNO2
Нітроген(IV)оксид (бурий газ) взаємодіє з водою з утворенням двох кислот – нітратної і нітритної:
2NO2 + H2O = HNO3 + HNO2
За наявності надлишку кисню у воді утворюється тільки нітратна кислота:

Бурий газ, що міститься у відхідних газах („лисячий хвіст”), шкідливих для всього живого, тепер розкладають за допомогою каталізатора:

Нітроген(V) оксид взаємодіє з водою з утворенням нітратної кислоти:
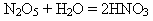
*визначте ступені окиснення нітрогену в таких сполуках:
N2O3,NCI3, N2H4, NaNO3 , Ba(NO3)2.
Оксиди Фосфору
| Фосфор(V) оксид
| Фосфор(ІІІ) оксид.
| | Емпірична формула P2O5
Це – безбарвна аморфна склоподібна або кристалічна речовина, має молекулярні кристалічні гратки, в узлах яких перебувають молекули P4H10
| Емпірична формула: P2O3
Це – пластівці або кристали з неприємним запахом, в узлах кристалічних граток містяться молекули P4O6
Кислотний оксид, дуже отруйний, розчиняється у воді
| Добувають фосфор(V) оксид спалюванням фосфору:
 Термічний продукт має вигляд білої снігоподібної маси, що складається з суміші різних форм фосфор(V) оксиду.
енергійно сполучається з водою і водяною парою, утворюючи фосфатні кислоти:
Термічний продукт має вигляд білої снігоподібної маси, що складається з суміші різних форм фосфор(V) оксиду.
енергійно сполучається з водою і водяною парою, утворюючи фосфатні кислоти:
 під час нагрівання до метафосфатної кислоти приєднується вода й утворюється ортофосфатна кислота:
під час нагрівання до метафосфатної кислоти приєднується вода й утворюється ортофосфатна кислота:
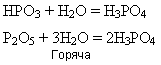 як кислотний оксидвзаємодіє з лугами та основними оксидами, утворюючи різні фосфати:
як кислотний оксидвзаємодіє з лугами та основними оксидами, утворюючи різні фосфати:
 як сильний дегідратуючий агент забирає воду від кислот, утворюючи їх кислотні оксиди, які не можна одержати розкладом цих кислот:
як сильний дегідратуючий агент забирає воду від кислот, утворюючи їх кислотні оксиди, які не можна одержати розкладом цих кислот:
 витісняє леткі кислотні оксиди з солей:
витісняє леткі кислотні оксиди з солей:

| Р+О2=Р2О3(при недостатній кількості кисню)
|
Оксиди Карбону
Карбон з Оксигеном утворює два оксиди: карбон(IV) оксид і карбон(ІІ) оксид.
Карбон(ІV) оксид (карбон діоксид, вуглекислий газ).
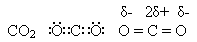
| Карбон(ІІ) оксид
СО(карбон монооксид, чадний газ)
| | Фізичні властивості.
безбарвний газ, без запаху, важчий за повітря у 1,5 рази, доволі добре розчиняється у воді, особливо під тиском, легко зріджується навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений карбон(ІV) оксид зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого частина газу перетворюється на снігоподібну масу – сухий лід.
| Фізичні властивості.
безбарвний газ, без запаху, погано розчиняється у воді, трохи легший за повітря, отруйний. Утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає здатність переносити кисень в організмі, настає кисневе голодування
|
Хімічні властивості.
Карбон(ІV) оксид – солетворний кислотний оксид. Він взаємодіє з водою, утворюючи нестійку карбонатну кислоту:
 взаємодіє з основами і основними оксидами, як у водних розчинах, так і з твердими, утворюючи солі – карбонати:
взаємодіє з основами і основними оксидами, як у водних розчинах, так і з твердими, утворюючи солі – карбонати:
 Якісна реакція на вуглекислий газ – помутніння вапняної води внаслідок утворення нерозчинного кальцій карбонату
Якісна реакція на вуглекислий газ – помутніння вапняної води внаслідок утворення нерозчинного кальцій карбонату
| Хімічні властивості.
Карбон(ІІ) оксид – несолетворний оксид. За стандартних умов не взаємодіє з водою, кислотами, лугами. Йому притаманні такі властивості:
здатність горіти васильково синім полум’ям, виділяючи велику кількість теплоти:
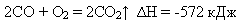 здатність відновлювати метали з оксидів:
здатність відновлювати метали з оксидів:
 взаємодіє з хлором з утворенням фосгену – отруйної речовини, що належить до хімічної зброї:
взаємодіє з хлором з утворенням фосгену – отруйної речовини, що належить до хімічної зброї:
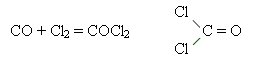 взаємодіє з твердим натрій гідроксидом з утворенням солі – натрій метаноат (форміат)
взаємодіє з твердим натрій гідроксидом з утворенням солі – натрій метаноат (форміат)

| Добування.
У лабораторії вуглекислий газ добувають дією хлоридної кислоти на мармур:
 У промисловості – прожарюванням вапняку:
У промисловості – прожарюванням вапняку:
 Використання.
Вуглекислий газ застосовують для:
виробництва соди;
гасіння пожеж (содові вогнегасники);
газування напоїв;
виготовлення сухого льоду для зберігання продуктів, які швидко псуються.
Використання.
Вуглекислий газ застосовують для:
виробництва соди;
гасіння пожеж (содові вогнегасники);
газування напоїв;
виготовлення сухого льоду для зберігання продуктів, які швидко псуються.
| Добування.
У лабораторії карбон(ІІ) оксид добувають з метанової (форміатної, мурашиної) кислоти під дією концентрованої сульфатної кислоти, яка відбирає воду:
 У промисловості його добувають різними способами:
внаслідок взаємодії карбон(IV) оксиду з розжареним вугіллям за температури понад 450OC в умовах нестачі повітря:
CO2 + C = 2CO#
дією водяної пари на розпечене вугілля:
У промисловості його добувають різними способами:
внаслідок взаємодії карбон(IV) оксиду з розжареним вугіллям за температури понад 450OC в умовах нестачі повітря:
CO2 + C = 2CO#
дією водяної пари на розпечене вугілля:
 Використання.
Карбон(ІІ) оксид застосовують:
для відновлення металів з їх оксидів;
в органічному синтезі (для добування спиртів, вуглеводів, альдегідів, карбонових кислот);
як висококалорійне паливо.
Використання.
Карбон(ІІ) оксид застосовують:
для відновлення металів з їх оксидів;
в органічному синтезі (для добування спиртів, вуглеводів, альдегідів, карбонових кислот);
як висококалорійне паливо.
|
Оксиди силіцію
| Силіцій(ІV) оксид
| Силіцій(ІІ) оксид
| | Силіцій(IV) оксид (силіцій діоксид, кремнезем), молекулярна формула SiO2
Структурна формула
Кристалічні гратки – атомні, кожна їх структурна одиниця являє собою тетраедр з атомом Силіцію в центрі та атомами Оксигену по вершинах. Це пояснюється тим, що атом Силіцію має більший радіус, ніж атом Карбону. Навколо нього може розміститись не два, а чотири атоми Оксигену, кожний з яких з’єднується з двома атомами Силіцію. Як показує наведена площинна схема, силіцій(IV) оксид має полімерну структуру:
Відмінністю у будові кристалічних граток пояснюється відмінність властивостей діоксидів Карбону і Силіцію.
Фізичні властивості.
Діоксид Силіцію – тверда, кристалічна, безбарвна, тугоплавка речовина, у воді не розчиняється
| Монооксид силіцію в природі не зустрічається,але може бути одержаний в електропечах при відновленні кремнезему силіцієм чи вугіллям.
Жовто-коричнева речовина,що повільно окислюється на повітрі до силіцій діоксиду.
| | Хімічні властивості.
Діоксид Силіцію – кислотний оксид. Взаємодіє у розплавах з лугами, основними оксидами, карбонатами лужних металів з утворенням силікатів:
Кислоти на Силіцій діоксид не діють, крім флуоридної (плавікової) кислоти
| Хімічні властивості.
Легкорозчинний в лугах.
| | Використання.
Силіцій діоксид у вигляді піску широко застосовується у будівництві, для добування скла, кераміки, порцеляни, фаянсу, цегли, цементу та ін. У вигляді кварцу силіцій діоксид використовують у радіотехніці, акустоелектроніці, оптичному приладобудуванні. Синтетичний силіцій діоксид („біла сажа”) служить наповнювачем у виробництві гуми.
| Використання.
Під технічною назвою моноокс застосовується для виготовлення деяких фарб,як електроізоляційний матеріал,і для фільтрування повітря
|
Сульфатна кислота
Молекулярна формула - H2SO4
Структурна формула - 
Ступінь окиснення Сульфуру +6.
Фізичні властивості.
Безводна сульфатна кислота – важка, безбарвна, оліїста рідина. Густина її концентрованого розчину (w(H2SO4) = 98%) за стандартних умов 1,84 г/см3. Вона нелетка, запаху не має. Надзвичайно гігроскопічна, активно вбирає вологу. Змішується з водою у будь-яких співвідношеннях. Розчинення сульфатної кислоти у воді супроводжується виділенням великої кількості теплоти. Сульфатна кислота – їдка рідина, роз’їдає папір, шкіру, тканини тощо.
Хімічні властивості багато в чому залежать від її концентрації.
|


 Атоми в молекулі зв’язані ковалентними полярними зв’язками, що утворюють кут 120O.
Ступінь окиснення Сульфуру +4: S+4O2-2
Атоми в молекулі зв’язані ковалентними полярними зв’язками, що утворюють кут 120O.
Ступінь окиснення Сульфуру +4: S+4O2-2
 Атоми в молекулі зв’язані ковалентними полярними зв’язками. Молекула має будову площинного трикутника з кутом між зв’язками 120O.
Атоми в молекулі зв’язані ковалентними полярними зв’язками. Молекула має будову площинного трикутника з кутом між зв’язками 120O.

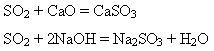


 3)Виявляє загальні властивості, що характерні для кислотних оксидів:
3)Виявляє загальні властивості, що характерні для кислотних оксидів:
 4)Виявляє сильні окисні властивості, відновлюючись зазвичай до сульфур(IV) оксиду:
4)Виявляє сильні окисні властивості, відновлюючись зазвичай до сульфур(IV) оксиду:

 б) взаємодією концентрованої сульфатної кислоти з міддю під час нагрівання;
б) взаємодією концентрованої сульфатної кислоти з міддю під час нагрівання;
 У промисловості – прожарюванням цинк сульфіду:
У промисловості – прожарюванням цинк сульфіду:
 або прожарюванням піриту (залізного колчедану), який можна розглядати як ферум(ІІ) сульфід, що містить вільну сірку 4FeS2+11O2=2Fe2O3+8SO2
або прожарюванням піриту (залізного колчедану), який можна розглядати як ферум(ІІ) сульфід, що містить вільну сірку 4FeS2+11O2=2Fe2O3+8SO2


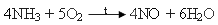


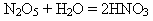
 Термічний продукт має вигляд білої снігоподібної маси, що складається з суміші різних форм фосфор(V) оксиду.
енергійно сполучається з водою і водяною парою, утворюючи фосфатні кислоти:
Термічний продукт має вигляд білої снігоподібної маси, що складається з суміші різних форм фосфор(V) оксиду.
енергійно сполучається з водою і водяною парою, утворюючи фосфатні кислоти:
 під час нагрівання до метафосфатної кислоти приєднується вода й утворюється ортофосфатна кислота:
під час нагрівання до метафосфатної кислоти приєднується вода й утворюється ортофосфатна кислота:
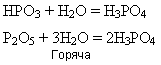 як кислотний оксидвзаємодіє з лугами та основними оксидами, утворюючи різні фосфати:
як кислотний оксидвзаємодіє з лугами та основними оксидами, утворюючи різні фосфати:
 як сильний дегідратуючий агент забирає воду від кислот, утворюючи їх кислотні оксиди, які не можна одержати розкладом цих кислот:
як сильний дегідратуючий агент забирає воду від кислот, утворюючи їх кислотні оксиди, які не можна одержати розкладом цих кислот:
 витісняє леткі кислотні оксиди з солей:
витісняє леткі кислотні оксиди з солей:

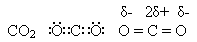
 взаємодіє з основами і основними оксидами, як у водних розчинах, так і з твердими, утворюючи солі – карбонати:
взаємодіє з основами і основними оксидами, як у водних розчинах, так і з твердими, утворюючи солі – карбонати:
 Якісна реакція на вуглекислий газ – помутніння вапняної води внаслідок утворення нерозчинного кальцій карбонату
Якісна реакція на вуглекислий газ – помутніння вапняної води внаслідок утворення нерозчинного кальцій карбонату
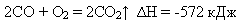 здатність відновлювати метали з оксидів:
здатність відновлювати метали з оксидів:
 взаємодіє з хлором з утворенням фосгену – отруйної речовини, що належить до хімічної зброї:
взаємодіє з хлором з утворенням фосгену – отруйної речовини, що належить до хімічної зброї:
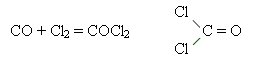 взаємодіє з твердим натрій гідроксидом з утворенням солі – натрій метаноат (форміат)
взаємодіє з твердим натрій гідроксидом з утворенням солі – натрій метаноат (форміат)

 У промисловості – прожарюванням вапняку:
У промисловості – прожарюванням вапняку:
 Використання.
Вуглекислий газ застосовують для:
виробництва соди;
гасіння пожеж (содові вогнегасники);
газування напоїв;
виготовлення сухого льоду для зберігання продуктів, які швидко псуються.
Використання.
Вуглекислий газ застосовують для:
виробництва соди;
гасіння пожеж (содові вогнегасники);
газування напоїв;
виготовлення сухого льоду для зберігання продуктів, які швидко псуються.
 У промисловості його добувають різними способами:
внаслідок взаємодії карбон(IV) оксиду з розжареним вугіллям за температури понад 450OC в умовах нестачі повітря:
CO2 + C = 2CO#
дією водяної пари на розпечене вугілля:
У промисловості його добувають різними способами:
внаслідок взаємодії карбон(IV) оксиду з розжареним вугіллям за температури понад 450OC в умовах нестачі повітря:
CO2 + C = 2CO#
дією водяної пари на розпечене вугілля:
 Використання.
Карбон(ІІ) оксид застосовують:
для відновлення металів з їх оксидів;
в органічному синтезі (для добування спиртів, вуглеводів, альдегідів, карбонових кислот);
як висококалорійне паливо.
Використання.
Карбон(ІІ) оксид застосовують:
для відновлення металів з їх оксидів;
в органічному синтезі (для добування спиртів, вуглеводів, альдегідів, карбонових кислот);
як висококалорійне паливо.




