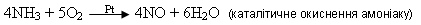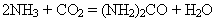Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Добування гідроген хлориду і хлоридної кислоти.
-У промисловості гідрогенхлорид добувають спалюванням водню в атмосфері хлору t H2 + Cl2 = 2HCl, - в лабораторії — за реакцією обмінуміж твердою сіллю (натрій хлоридом) іконцентрованою сульфатною кислотою: 2NaCl (тв.) + H2SO4 (конц.) = 2HCl↑ + Na2SO4 Таким способом раніше добували хлороводень і в промисловості. *Зазначити метали, з якими реагуватиме хлоридна кислота: Na, Ba, Ag, K, Ca, Ni, Mg, Al, Zn, Pb, Cr, Cu. Застосування: Виробництво соди, натрій гідроксиду, хлору, натрію Кулінарія, консервування. Харчова промисловість У суміші з піском для розтоплення льоду на дорогах Осушувач газів, органічних розчинників Виробництво кальцію Компонент охолоджувальних сумішей Лікарський засіб при алергії, кровотечі Виробництво калій гідроксиду Мінеральне добриво *Який заряд (ступінь окиснення) за величиною та за знаком має хлор в наступних сполуках: HCl, HClO, Cl2O7, HСlO4, Ca(OCl)2? *Дано: хлоридну к-ту, калій оксид, цинк, воду, аргентум оксид. Як з них та продуктів їх реакцій добути дві складні та дві прості речовини? Складіть рівняння реакцій, назвіть їх продукти, зазначте типи реакцій. Здійсніть класифікацію реагентів та продуктів реакцій. Амоніак • Зазначте електронні формули атомів Нітрогену і Гідрогену, покажіть графічно розміщення електронів по орбіталях і поясніть, якими електронами утворюється ковалентний зв'язок у молекулі аміаку і чому він полярний. Яка валентність і ступінь окиснення Нітрогену в аміаку? Молекулярна формула NH3 Молекула має форму піраміди з атомом Нітрогену у вершині та кутом 107° між ковалентними полярними зв’язками N – H, внаслідок чого вона полярна. Ступінь окиснення Нітрогену становить -3. У природі амоніак утворюється під час гниття органічних решток. Фізичні властивості. Амоніак – безбарвний газ, з різким запахом, набагато легший за повітря, дуже добре розчиняється у воді (за температури 20OC в 1 об’ємі води – 700 об’ємів амоніаку). Водний розчин амоніаку називають амоніачною водою, або нашатирним спиртом, масова частка амоніаку в ньому дорівнює 25%. Амоніак легко зріджується, за температури -33,4OC переходить у рідкий стан. Хімічні властивості. 1)горіння Як відновник амоніак окиснюється киснем і горить у ньому зеленкуватим полум’ям. 4NH3 + 3O2 = 2N2 + 6H2O (горінняамоніаку)
2)неповне окиснення За наявності каталізатора (Pt, Fe2O3) і нагрівання під час окиснення амоніаку утворюються два оксиди:
• Складіть для наведених рівнянь електронний баланс, обґрунтуйте розстановку коефіцієнтів і доведіть, що аміак в обох випадках — відновник. 3)взаємодія з водою Амоніак взаємодіє з водою. Велика розчинність амоніаку у воді пояснюється утворенням водневих зв’язків між молекулами амоніаку і води:
Встановлюється рівновага:
У розчині лише невелика частка молекул амоніаку перетворюється на йони амонію, тому амоніачна вода пахне амоніаком. ЇЇ позначають формулою NH3 · H2O і називають амоній гідроксидом або нашатирним спиртом. Він належить до слабких і нестійких основ:
4)взаємодія з кислотами Амоніак взаємодіє з кислотами, утворюючи солі амонію: *напишіть реакції взаємодії амоніаку з хлоридною,нітратною,сульфатною,фосфатною кислотами Амоній-іон NH4+ -це комплексний йон. Він утворюється внаслідок приєднання молекулою амоніаку протона (йона Гідрогену), що відщеплюється від молекули кислоти або води. Виникаєковалентний зв’язокза донорно-акцепторним механізмом: атом Нітрогену амоніаку – донор, а йон Гідрогену – акцептор. Усі чотири зв’язки N – H в йоні амонію рівноцінні, незважаючи на різні механізми їх утворення. *Що спільного і відмінного між речовинами, назви яких «нашатир» і «нашатирний спирт»? . Добування. -У лабораторії амоніак добувають із суміші твердих речовин – нашатирю NH4Cl і гашеного вапна Ca(OH)2: Добування аніаку в лабораторних умовах.
-У промисловості амоніак синтезують із простих речовин азоту і водню:
Реакція оборотна, екзотермічна, відбувається між газами із зменшенням об’єму. Звідси оптимальні умови синтезу амоніаку: застосування тиску (30 МПа) для зміщення рівноваги у бік утворення амоніаку; використання каталізатору (Fe); підвищення температури (450- 550OC). Використання. Амоніак застосовують: для виробництва нітратної кислоти, солей амонію, вибухових речовин, соди, барвників; як добривоі для добування азотних добрив, у тім числі й карбаміду (сечовини):
як холодоагент у холодильних установках;
у медицині як нашатирний спирт; у хімічних лабораторіях як слабкий луг; у побуті під час прання білизни, для виведення плям, чищення килимів і ювелірних виробів. Солі амонію Солі амонію – кристалічні речовини з йонним типом зв’язку, до складу яких входить один або кілька катіонів амонію та аніон кислотного залишку. Хімічні властивості . Солі амонію – сильні електроліти: у водних розчинах дисоціюють на йони:
взаємодіють з іншими солями, відбувається реакція йонного обміну:
взаємодіють з лугами з виділенням амоніаку:
|
||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 468; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.200.143 (0.01 с.) |